Har et væske- eller gasmolekyle større bevægelse?
Forklaring:
* gasmolekyler Har en meget højere kinetisk energi end flydende molekyler. De bevæger sig konstant i tilfældige retninger i høje hastigheder og kolliderer med hinanden og væggene i deres beholder. Denne høje kinetiske energi skyldes de svage intermolekylære kræfter mellem gasmolekyler, hvilket giver dem mulighed for at bevæge sig frit.
* flydende molekyler har svagere intermolekylære kræfter end faste stoffer, men stærkere end gasser. De kan bevæge sig rundt og glide forbi hinanden, men er stadig relativt tæt sammen. Denne begrænsede bevægelse fører til lavere kinetisk energi sammenlignet med gasser.
Nøgleforskelle:
| Ejendom | Gas | Væske |
| --- | --- | --- |
| Kinetisk energi | Høj | Moderat |
| Intermolekylære kræfter | Svag | Moderat |
| Molekylær bevægelse | Hurtig og tilfældig | Moderat og flydende |
| Densitet | Lav | Høj |
Kortfattet: Gasmolekyler har større bevægelse på grund af deres højere kinetiske energi og svagere intermolekylære kræfter, hvilket giver dem mulighed for at bevæge sig frit og tilfældigt.
 Varme artikler
Varme artikler
-
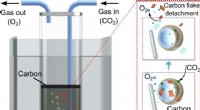 Flydende metal har vist sig at være en billig og effektiv CO2 -omformerUNSW -forskere har hjulpet med at vise, hvordan kuldioxid kan nedbrydes billigt og effektivt via en proces, der opløser fanget CO2 -gas i et opløsningsmiddel omkring nanopartikler af gallium. Kredit:U
Flydende metal har vist sig at være en billig og effektiv CO2 -omformerUNSW -forskere har hjulpet med at vise, hvordan kuldioxid kan nedbrydes billigt og effektivt via en proces, der opløser fanget CO2 -gas i et opløsningsmiddel omkring nanopartikler af gallium. Kredit:U -
 Enhed, der anvender molekylær teknik, kunne give ultrafølsomme, automatiseret system til at opdage…Jacqueline Linnes, en assisterende professor ved Purdues Weldon School of Biomedical Engineering, udvikler nukleinsyreamplifikationstest trykt på papir for at muliggøre en lav pris, automatiseret syst
Enhed, der anvender molekylær teknik, kunne give ultrafølsomme, automatiseret system til at opdage…Jacqueline Linnes, en assisterende professor ved Purdues Weldon School of Biomedical Engineering, udvikler nukleinsyreamplifikationstest trykt på papir for at muliggøre en lav pris, automatiseret syst -
 CMU bliver stedet for maskinlæring i katalyseforskningKredit:Institut for Kemiteknik, Carnegie Mellon University Katalysatorer skaber forandring. Mange naturfagslærere på mellemtrinnet har dryppet et par dråber kaliumiodid i brintoverilte og set d
CMU bliver stedet for maskinlæring i katalyseforskningKredit:Institut for Kemiteknik, Carnegie Mellon University Katalysatorer skaber forandring. Mange naturfagslærere på mellemtrinnet har dryppet et par dråber kaliumiodid i brintoverilte og set d -
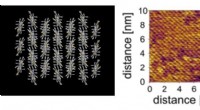 Cellemembran inspirerer til ny ultratynd elektronisk filmSet ovenfra af 3D-computermodel (venstre) og Atomic Force Microscopy-billede (højre) af den nye film lavet af videnskabsmænd fra University of Tokyo. Molekylernes velorganiserede struktur er synlig i
Cellemembran inspirerer til ny ultratynd elektronisk filmSet ovenfra af 3D-computermodel (venstre) og Atomic Force Microscopy-billede (højre) af den nye film lavet af videnskabsmænd fra University of Tokyo. Molekylernes velorganiserede struktur er synlig i
- Grundlæggende mekanik hjælper med at øge batteriets lagerkapacitet og levetid
- Hvilken måne har en retrograd bane?
- Raket med argentinsk satellit letter med succes
- Hvad producerer bakterierne i store tarm?
- Hvad er den største forskel mellem jordvandsøkosystemer?
- Opdagelse af en hybrid hudtopologisk effekt induceret af gevinst og tab


