Hvad er ladningen for et element, når det danner en forbindelse?
Her er en sammenbrud:
* Oxidationstilstand er et tal, der repræsenterer antallet af elektroner, som et atom har opnået, mistet eller delt, når det danner en kemisk binding.
* positiv oxidationstilstand Angiver, at et atom har mistet elektroner.
* negativ oxidationstilstand Angiver, at et atom har vundet elektroner.
* nul oxidationstilstand Angiver, at et atom hverken har opnået eller mistet elektroner (som i elementær form).
Bestemmelse af oxidationstilstand:
* regler: Der er specifikke regler for tildeling af oxidationstilstande til elementer i forbindelser. Disse regler er baseret på elektronegativitet og den kendte tendens til elementer til at vinde eller miste elektroner.
* forudsigelse fra gruppe: Elementer i den samme gruppe (lodret kolonne) i den periodiske tabel har ofte den samme oxidationstilstand, når de danner forbindelser.
* Almindelig oxidation siger: Nogle elementer har forudsigelige oxidationstilstande i de fleste forbindelser, som:
* Alkali Metals (+1)
* Alkaliske jordmetaller (+2)
* Halogener (-1)
* Ilt (-2)
Eksempel:
* I NaCl (natriumchlorid) har natrium (NA) en oxidationstilstand på +1, og chlor (CL) har en oxidationstilstand på -1.
Nøglepunkter:
* Summen af oxidationstilstandene i en neutral forbindelse skal svare til nul.
* Oxidationstilstande kan i nogle tilfælde være fraktioneret.
* Det er vigtigt at forstå reglerne for tildeling af oxidationstilstande til at forudsige og forstå opførelsen af elementer i forbindelser.
Fortæl mig, hvis du har flere spørgsmål eller gerne vil udforske specifikke eksempler!
Sidste artikelHvad er den mest metalliske elementer?
Næste artikelHvad er 3 forskellige former for rent kulstof?
 Varme artikler
Varme artikler
-
 Adskillelse af gasser ved hjælp af fleksible molekylsigterMolekylærsigternes dynamiske natur og fleksibilitet er afgørende for at forstå deres ydeevne til transport af små molekyler. Kredit:University of Liverpool Forskere ved University of Liverpool og
Adskillelse af gasser ved hjælp af fleksible molekylsigterMolekylærsigternes dynamiske natur og fleksibilitet er afgørende for at forstå deres ydeevne til transport af små molekyler. Kredit:University of Liverpool Forskere ved University of Liverpool og -
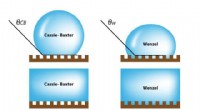 Forståelse af overfladevidenskab til fremstilling af kosmetik af høj kvalitetBefugtningsovergangen fra Cassie-Baxter-tilstand til Wenzel-tilstand på strukturerede overflader. Kredit:UNIST Et forskerhold tilknyttet UNIST har undersøgt hastighederne for væskepenetration på r
Forståelse af overfladevidenskab til fremstilling af kosmetik af høj kvalitetBefugtningsovergangen fra Cassie-Baxter-tilstand til Wenzel-tilstand på strukturerede overflader. Kredit:UNIST Et forskerhold tilknyttet UNIST har undersøgt hastighederne for væskepenetration på r -
 Nylon som byggesten til gennemsigtige elektroniske enheder?Gennemsigtig nylon kan være en vigtig byggesten for udviklingen af transparente elektroniske kredsløb i fremtiden. Kredit:MPI-P Forskere ved Max Planck Institute for Polymer Research (MPI-P) led
Nylon som byggesten til gennemsigtige elektroniske enheder?Gennemsigtig nylon kan være en vigtig byggesten for udviklingen af transparente elektroniske kredsløb i fremtiden. Kredit:MPI-P Forskere ved Max Planck Institute for Polymer Research (MPI-P) led -
 Forskere laver ny opskrift på kringleformede peptiderDr. Christoph Nitsche. Kredit:Australian National University Forskere fra The Australian National University (ANU) har udviklet en ny måde at syntetisere bicykliske peptider på, med store konsekven
Forskere laver ny opskrift på kringleformede peptiderDr. Christoph Nitsche. Kredit:Australian National University Forskere fra The Australian National University (ANU) har udviklet en ny måde at syntetisere bicykliske peptider på, med store konsekven
- Forskel mellem et atom og et mulekyle?
- Rummet -- den næste grænse for Hillary Clinton?
- Hvilken af disse bidrager ikke til skiftende sæsoner vinkelforekomst Solstråling vipper jorden p…
- Hvad er egenskaberne ved hvert lagsol?
- Hvorfor bruges varmt vand i stedet for koldt til krystaller?
- Hvordan umulige farver (som Stygian Blue) fungerer


