Hvad får en forbindelse til at dannes fra elementer?
1. Elektronkonfiguration og stabilitet:
* Atomer stræber efter en stabil konfiguration, der ligner de ædle gasser med deres fyldte ydre elektronskaller. Dette er kendt som octet -reglen .
* For eksempel har natrium (NA) et elektron i sin ydre skal, mens klor (CL) har syv. Natrium kan opnå stabilitet ved at miste en elektron, mens klor kan få et elektron.
2. Typer af kemiske bindinger:
* ionisk binding: Dette forekommer, når et atom mister elektroner (danner en positiv ion), og et andet atom får elektroner (danner en negativ ion). Den elektrostatiske tiltrækning mellem disse modsatte ladede ioner holder dem sammen.
* Eksempel:Natrium (Na+) og chlor (Cl-) danner forbindelsen natriumchlorid (NaCI) på grund af ionisk binding.
* kovalent binding: Dette forekommer, når atomer deler elektroner for at opnå en fuld ydre skal. Disse delte elektroner betragtes som en del af begge atomer.
* Eksempel:Hydrogen (H) har en elektron, og ilt (O) har seks. To hydrogenatomer deler deres elektroner med et iltatom og danner vand (H₂O).
* Metallisk binding: Dette forekommer mellem metalatomer, hvor elektroner delokaliseres og deles gennem hele metalstrukturen.
3. Faktorer, der påvirker dannelse af sammensat:
* Elektronegativitet: Et atoms tendens til at tiltrække elektroner. En stor forskel i elektronegativitet mellem atomer favoriserer ionisk binding, mens en mindre forskel favoriserer kovalent binding.
* Energiovervejelser: Obligationsdannelse ledsages normalt af en frigivelse af energi, hvilket gør den energisk gunstig.
* reaktionsbetingelser: Temperatur, tryk og tilstedeværelse af katalysatorer kan påvirke hastigheden og typen af kemiske reaktioner, der fører til dannelse af sammensat.
Sammenfattende er drivkraften bag dannelse af sammensat atomer at opnå en stabil elektronkonfiguration, som de opnår gennem forskellige kemiske bindinger.
Sidste artikelHvad er smeltepunktet for polyimid?
Næste artikelRegionen i et atom, der indeholder det meste af massen, kaldes?
 Varme artikler
Varme artikler
-
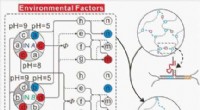 Ændring af blødt stofs form ved hjælp af logiske kredsløb lavet af DNAKredit: Angewandte Chemie International Edition (2021). DOI:10.1002/anie.202102169 De utallige processer, der foregår i biologiske celler, kan ved første øjekast virke utroligt komplekse. Og stad
Ændring af blødt stofs form ved hjælp af logiske kredsløb lavet af DNAKredit: Angewandte Chemie International Edition (2021). DOI:10.1002/anie.202102169 De utallige processer, der foregår i biologiske celler, kan ved første øjekast virke utroligt komplekse. Og stad -
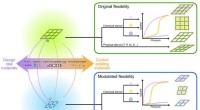 Mod design/styring af fleksibilitet af MOF'erFleksible metal-organiske rammer:fra at kontrollere konstruktionerne til at kontrollere fleksibiliteten. Kredit:Science China Press Porøse koordineringspolymerer (PCPer) eller metal-organiske ramm
Mod design/styring af fleksibilitet af MOF'erFleksible metal-organiske rammer:fra at kontrollere konstruktionerne til at kontrollere fleksibiliteten. Kredit:Science China Press Porøse koordineringspolymerer (PCPer) eller metal-organiske ramm -
 Forskere fremstiller gennemsigtig keramik af høj kvalitetKredit:CC0 Public Domain Mid-infrarøde lasere er blevet meget brugt til billeddannelse, opdagelse, diagnostik, miljøovervågning, medicin, industri, forsvar og andre. Til mellem-infrarøde lasersyst
Forskere fremstiller gennemsigtig keramik af høj kvalitetKredit:CC0 Public Domain Mid-infrarøde lasere er blevet meget brugt til billeddannelse, opdagelse, diagnostik, miljøovervågning, medicin, industri, forsvar og andre. Til mellem-infrarøde lasersyst -
 CRISPR udvinder bakteriegenom til skjulte farmaceutiske skatteIllinois-forskere brugte CRISPR-teknologi til at aktivere tavse genklynger i Streptomyces bakterie, en potentiel skatkammer af nye klasser af stoffer. Afbildet, med uret bagfra i midten:kandidatstud
CRISPR udvinder bakteriegenom til skjulte farmaceutiske skatteIllinois-forskere brugte CRISPR-teknologi til at aktivere tavse genklynger i Streptomyces bakterie, en potentiel skatkammer af nye klasser af stoffer. Afbildet, med uret bagfra i midten:kandidatstud
- Hvilken tilstand af stof har brint?
- Er aluminium et alkalisk jordmetal?
- Matematik. Videnskab. Fordybning. Minecraft? Twitch club bringer gaming til skolen
- Mandlige videnskabsmænd er mere tilbøjelige til at bruge sprog og indramme deres forskningsresulta…
- Opbryder en plante sukker og frigiver energi ved hjælp af proces kaldet femantation?
- Hvad er det vigtigste mineral, som kontinentale og oceaniske plader består af?


