Hvorfor afhænger et stofs specifikke varmekapacitet af fase?
1. Molekylær arrangement:
* fast: Molekyler er tæt pakket i en stiv, ordnet struktur. De vibrerer rundt om faste positioner, men deres bevægelse er begrænset.
* væske: Molekyler er mere løst pakket end i faste stoffer og kan bevæge sig frit. De har mere translationel og rotationsbevægelse.
* gas: Molekyler er vidt adskilt og bevæger sig hurtigt med høj kinetisk energi. De kolliderer ofte, men deres interaktioner er svagere end i væsker eller faste stoffer.
2. Energiabsorption:
* fast: Når du tilføjer varme til et fast stof, går energien hovedsageligt til at øge molekylernes vibrationsenergi. Dette er grunden til, at faste stoffer har en relativt lav specifik varmekapacitet.
* væske: I væsker går energien ind i både øget translationel og rotationsbevægelse af molekylerne. Dette kræver mere energi for at hæve temperaturen, hvilket resulterer i en højere specifik varmekapacitet end faste stoffer.
* gas: I gasser går energien til at øge den translationelle bevægelse og kollisioner mellem molekyler. Da gasmolekyler er langt fra hinanden og interagerer svagt, kræver de en masse energi for at øge deres temperatur, hvilket fører til den højeste specifikke varmekapacitet blandt de tre faser.
3. Intermolekylære kræfter:
* fast: Intermolekylære kræfter er stærke og holder molekylerne i et fast arrangement. Dette kræver en masse energi for at bryde strukturen og overgangen til en flydende fase.
* væske: Intermolekylære kræfter er svagere end i faste stoffer, hvilket gør det muligt for molekyler at bevæge sig frit rundt. De spiller stadig en rolle i at påvirke den energi, der kræves til temperaturændringer.
* gas: Intermolekylære kræfter er ubetydelige i gasser. Molekyler er i det væsentlige uafhængige, og den energi, der kræves for at hæve temperaturen, er primært relateret til molekylernes kinetiske energi.
Kortfattet:
Den specifikke varmekapacitet er i det væsentlige et mål for, hvor meget energi der er nødvendig for at øge temperaturen på et stof. Arrangementet, bevægelsen og interaktioner mellem molekyler i forskellige faser påvirker drastisk, hvordan de absorberer og opbevarer energi. Dette er grunden til, at den specifikke varmekapacitet ændres markant mellem faste, flydende og gasformige tilstande.
 Varme artikler
Varme artikler
-
 COVID-åndedrætstest-kan det være det næste? Forskning siger jaFra venstre:University of Canterbury forskere postdoktor Dr. Fiona Given og lektor Deborah Crittenden ved Biomolecular Interaction Center. Kredit:University of Canterbury Enhver, der har oplevet e
COVID-åndedrætstest-kan det være det næste? Forskning siger jaFra venstre:University of Canterbury forskere postdoktor Dr. Fiona Given og lektor Deborah Crittenden ved Biomolecular Interaction Center. Kredit:University of Canterbury Enhver, der har oplevet e -
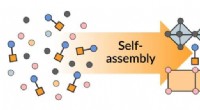 En enkel måde at få komplekse halvledere til at samle sig selvEt diagram viser, hvordan lag af to 2D-materialer – en perovskit (blå) og et metalhalogenid (gul) – samler sig ud af kemikalier, der vælter rundt i vand (til venstre). Forsamlingen styres af linkermol
En enkel måde at få komplekse halvledere til at samle sig selvEt diagram viser, hvordan lag af to 2D-materialer – en perovskit (blå) og et metalhalogenid (gul) – samler sig ud af kemikalier, der vælter rundt i vand (til venstre). Forsamlingen styres af linkermol -
 Forskere designer måde at bruge harmløse bakterier til at opdage tungmetaller i drikkevand(L-R) Gregoire Thouvenin og Nicholas Csicsery i UCSD Biodynamics Lab drevet af bioingeniør- og biologiprofessor Jeff Hasty ved UC San Diego. Kredit:University of California - San Diego Når det ko
Forskere designer måde at bruge harmløse bakterier til at opdage tungmetaller i drikkevand(L-R) Gregoire Thouvenin og Nicholas Csicsery i UCSD Biodynamics Lab drevet af bioingeniør- og biologiprofessor Jeff Hasty ved UC San Diego. Kredit:University of California - San Diego Når det ko -
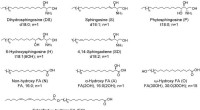 Forskere beskriver hele udvalget af ceramider, der findes i det øverste lag af menneskelig hudStrukturer af komponenterne i humane ceramider. Forkortelserne brugt i denne undersøgelse er vist i parentes efter hvert sammensatte navn, og de anbefalede standardnavne er vist under dem. Kredit:Mado
Forskere beskriver hele udvalget af ceramider, der findes i det øverste lag af menneskelig hudStrukturer af komponenterne i humane ceramider. Forkortelserne brugt i denne undersøgelse er vist i parentes efter hvert sammensatte navn, og de anbefalede standardnavne er vist under dem. Kredit:Mado
- Hvad har du for at frigive energien fra et brændstof?
- Børn født af voldtægt:Den ødelæggende arv fra seksuel vold i Rwanda efter folkedrabet
- Hvordan adskiller glukose sig fra saccharose og cellulosestivelse?
- Fordele og ulemper ved at spare energi?
- Miljømæssige risici ved myggekontrol med Bacillus thuringiensis israelensis (Bti)
- Hvilken farve er en kløft?


