Gør tilføjelse af pres til en gas det lettere at opløses i opløsningsmiddel?
Henrys lov siger, at opløseligheden af en gas i en væske er direkte proportional med det delvise tryk på gassen over væsken. På enklere termer, jo højere tryk på gassen, desto mere opløses det i væsken.
Her er hvorfor:
* Forøgede tryk tvinger flere gasmolekyler i kontakt med opløsningsmidlet. Det øgede tryk skubber gasmolekylerne tættere sammen, øger deres koncentration og gør dem mere tilbøjelige til at kollidere med opløsningsmiddelmolekylerne.
* Forøgede kollisioner fører til mere opløst gas. Når gasmolekyler kolliderer med opløsningsmidlet, kan de danne svage bindinger og opløses. Jo højere tryk, jo flere kollisioner forekommer, og jo mere gas opløses.
Eksempler:
* kulsyreholdige drikkevarer: Kuldioxidgas i soda opløses under højt tryk. Når trykket frigøres (f.eks. Når du åbner dåsen), slipper gassen ud og forårsager fizzing.
* scuba dykning: Dykkere indånder komprimeret luft, og det øgede tryk får nitrogen til at opløses i deres blod. Hvis opstigningen er for hurtig, falder trykket for hurtigt, og det opløste nitrogen kan danne bobler i blodet, hvilket fører til dekomprimeringssyge.
Vigtig note:
Mens Henrys lov er et generelt princip, er der undtagelser. Opløseligheden af en gas i en væske kan også afhænge af faktorer som temperatur, arten af gas og opløsningsmiddel og tilstedeværelsen af andre opløste stoffer.
Sidste artikelVæsker danner sfæriske dråber på grund af hvilken ejendom?
Næste artikelHvilket metal har det næst laveste smeltepunkt?
 Varme artikler
Varme artikler
-
 Forskere opdager en hurtigere måde at fremstille vaskulære materialer påSynkroniseret fremstilling af en bioinspireret struktur med et hierarkisk vaskulært netværk. Kredit:Mayank Garg, Nancy Sottos, Jeff Moore, og Phillipe Guebelle At udvikle selvhelbredende materiale
Forskere opdager en hurtigere måde at fremstille vaskulære materialer påSynkroniseret fremstilling af en bioinspireret struktur med et hierarkisk vaskulært netværk. Kredit:Mayank Garg, Nancy Sottos, Jeff Moore, og Phillipe Guebelle At udvikle selvhelbredende materiale -
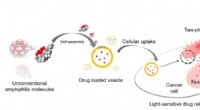 Ny teknologi til levering af kræft mod kræftOversigt over forsøget. Hule græskarformede molekyler med allyloxyhaler samler sig selv i vesikler, som kan transportere lægemidler ind i kræftceller. Derefter bryder en laser vesiklerne, hvilket lett
Ny teknologi til levering af kræft mod kræftOversigt over forsøget. Hule græskarformede molekyler med allyloxyhaler samler sig selv i vesikler, som kan transportere lægemidler ind i kræftceller. Derefter bryder en laser vesiklerne, hvilket lett -
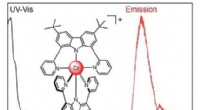 Et nyt kromkompleks udsender lys i uhåndgribelig NIR-II-bølgelængdeKredit:Wiley Mange applikationer, fra fiberoptisk telekommunikation til biomedicinske billeddannelsesprocesser kræver stoffer, der udsender lys i det nær-infrarøde område (NIR). Et forskerhold i S
Et nyt kromkompleks udsender lys i uhåndgribelig NIR-II-bølgelængdeKredit:Wiley Mange applikationer, fra fiberoptisk telekommunikation til biomedicinske billeddannelsesprocesser kræver stoffer, der udsender lys i det nær-infrarøde område (NIR). Et forskerhold i S -
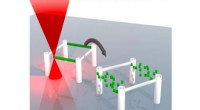 Sletbar blæk til 3D-udskrivningKredit:Karlsruhe Institute of Technology 3D-udskrivning ved direkte laserskrivning producerer strukturer i mikrometerstørrelse med præcist definerede egenskaber. Forskere ved Karlsruhe Institute o
Sletbar blæk til 3D-udskrivningKredit:Karlsruhe Institute of Technology 3D-udskrivning ved direkte laserskrivning producerer strukturer i mikrometerstørrelse med præcist definerede egenskaber. Forskere ved Karlsruhe Institute o
- Hvad er et stof, der skifter farve, når en syre eller base tilsættes?
- Hvilken energi bruger en opvaskemaskine?
- Hvad ville der ske med din vægt, hvis du gik månen?
- Hvorfor eksperter siger, at græsplæner bør blive en saga blot
- NOAA-værktøj bringer nu katastroferisiko, sårbarhed ned på fællesskabsniveau
- Sådan sporer prognosemænd orkanen Dorian


