Hvordan adskiller polormolekyler sig fra ikke -politiske molekyler?
polære molekyler
* ujævn fordeling af ladning: Polære molekyler har en ujævn fordeling af elektrondensitet, hvilket betyder, at den ene ende af molekylet har en delvis positiv ladning (δ+), og den anden ende bærer en delvis negativ ladning (Δ-).
* Årsag: Denne ujævnhed stammer fra forskelle i elektronegativitet mellem atomerne i molekylet. Elektronegativitet er en atoms evne til at tiltrække elektroner. Når det ene atom i en binding er mere elektronegativ end den anden, trækker det de delte elektroner tættere, hvilket skaber en delvis negativ ladning på dette atom og en delvis positiv ladning på det mindre elektronegative atom.
* Eksempler: Vand (H₂O), ammoniak (NH₃), ethanol (Ch₃ch₂OH), saltsyre (HCI)
* egenskaber:
* Højere kogepunkter: De delvise ladninger i polære molekyler giver dem mulighed for at danne stærke dipol-dipol-interaktioner, som kræver mere energi for at bryde.
* opløselighed i polære opløsningsmidler: Polære molekyler opløses godt i polære opløsningsmidler (som vand), fordi de kan danne stærke interaktioner med opløsningsmiddelmolekylerne.
* Evne til at danne brintbindinger: Hydrogenbindinger er en særlig stærk type dipol-dipolinteraktion, der forekommer, når brint er bundet til et stærkt elektronegativt atom som ilt eller nitrogen.
ikke -polære molekyler
* Even Distribution of Charge: Ikke -polære molekyler har en afbalanceret fordeling af elektroner, så der er ingen områder med lokaliseret positiv eller negativ ladning.
* Årsag: Dette sker normalt, når atomerne i molekylet har lignende elektronegativiteter, eller når molekylet har en symmetrisk form, der annullerer enhver potentiel polaritet.
* Eksempler: Methan (CH₄), kuldioxid (co₂), ilt (O₂), helium (HE)
* egenskaber:
* lavere kogepunkter: Ikke -polære molekyler har svagere intermolekylære kræfter (van der Waals -kræfter) end polære molekyler, hvilket kræver mindre energi for at bryde fra hinanden.
* opløselighed i ikke -polære opløsningsmidler: Ikke -polære molekyler opløses godt i ikke -polære opløsningsmidler (som olie eller hexan) på grund af lignende intermolekylære kræfter.
* generelt ikke i stand til at danne brintbindinger.
Nøgleforskel: Tilstedeværelsen eller fraværet af et dipolmoment (et mål for adskillelsen af ladninger) adskiller polære og ikke -polære molekyler. Polære molekyler har et dipolmoment, mens ikke -polære molekyler har et nul dipolmoment.
Kortfattet: Forskellen mellem polære og ikke -polære molekyler er de ujævne (polære) eller endda (ikke -polære) fordeling af elektrondensitet, hvilket resulterer i forskellige egenskaber relateret til deres interaktion med andre molekyler og deres fysiske opførsel.
Sidste artikelHvorfor er det farligt at lugte kemikalier i et videnskabslaboratorium?
Næste artikelHvad er de sensibiliserede materialer?
 Varme artikler
Varme artikler
-
 SLACs højhastighedselektronkamera filmer molekylær film i HDForskere skabte den første film med atomopløsning af ringåbningsreaktionen af 1, 3-cyclohexadien (CHD) med et elektronkamera kaldet UED. Nederst:UED-elektronstrålen måler nøjagtigt afstandene mellem
SLACs højhastighedselektronkamera filmer molekylær film i HDForskere skabte den første film med atomopløsning af ringåbningsreaktionen af 1, 3-cyclohexadien (CHD) med et elektronkamera kaldet UED. Nederst:UED-elektronstrålen måler nøjagtigt afstandene mellem -
 Forskere syntetiserer helbredende forbindelser i skorpiongiftStanford Kemi Professor Richard Zare holder den mexicanske skorpion art Diplocentrus melici i hans hånd. Kredit:Edson N. Carcamo-Noriega En skorpion hjemmehørende i det østlige Mexico kan have m
Forskere syntetiserer helbredende forbindelser i skorpiongiftStanford Kemi Professor Richard Zare holder den mexicanske skorpion art Diplocentrus melici i hans hånd. Kredit:Edson N. Carcamo-Noriega En skorpion hjemmehørende i det østlige Mexico kan have m -
 Nye værktøjer til undersøgelse af bioaktive lipiderKredit:CC0 Public Domain NAEer er bioaktive lipidmolekyler, der ser ud til at spille roller i energibalancen, betændelse, stressreaktioner og afhængighed. Hvordan NAE -niveauer reguleres og deres
Nye værktøjer til undersøgelse af bioaktive lipiderKredit:CC0 Public Domain NAEer er bioaktive lipidmolekyler, der ser ud til at spille roller i energibalancen, betændelse, stressreaktioner og afhængighed. Hvordan NAE -niveauer reguleres og deres -
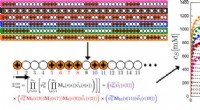 Forskere kan nu forudsige egenskaber af uordnede polymererKredit:ACS Takket være et team af forskere fra University of Illinois i Urbana-Champaign og University of Massachusetts Amherst, forskere er i stand til at læse mønstre på lange kæder af molekyler
Forskere kan nu forudsige egenskaber af uordnede polymererKredit:ACS Takket være et team af forskere fra University of Illinois i Urbana-Champaign og University of Massachusetts Amherst, forskere er i stand til at læse mønstre på lange kæder af molekyler
- Folk over hele verden går ind for betalt forældreorlov, undersøgelse finder
- De fleste tidligere undersøgelser om forskelsbehandling kiggede på voksne, undersøgelse siger
- Hvilken energikilde anses for ikke-vedvarende?
- Sådan skriver du tal i udvidet form
- Forskere viser, at pesticidforurening er mere end æbleskind dyb
- Kunstvandet landbrug i Wisconsins centrale sand afkøler regionens klima


