Hvad sker der, hvis en opløsning ændrer sig fra PH5 til PH6?
* ph -skala: PH -skalaen er logaritmisk, hvilket betyder, at hvert hele antal ændringer repræsenterer en ti gange forskel i hydrogenionkoncentration.
* Hydrogenioner: En lavere pH indikerer en højere koncentration af brintioner (H+), hvilket gør opløsningen mere sur.
* Skift af balancen: En ændring fra pH 5 til pH 6 betyder et fald i hydrogenionkoncentration med en faktor 10.
i enklere termer:
Forestil dig, at du har et glas appelsinsaft med en pH på 5. Det er ret surt. Forestil dig nu, at du tilføjer en lille mængde bagepulver (som er grundlæggende). Bagepulveren neutraliserer nogle af syren, hvilket reducerer hydrogenionkoncentrationen, og pH øges til 6. Mens den stadig er sur, er appelsinsaften nu 10 gange mindre sur end den var før.
Vigtig note: Den nøjagtige ændring i surhedsgrad afhænger af den specifikke løsning og konteksten. For eksempel er en ændring fra pH 5 til pH 6 i en meget sur opløsning muligvis ikke så signifikant som den samme ændring i en let sur opløsning.
 Varme artikler
Varme artikler
-
 Forskere bruger røntgenstråler til at forstå fejlene ved batterihurtig opladningDa lithium-ioner bevæger sig hurtigt mellem elektroderne på et batteri, de kan danne inaktive lag af lithiummetal i en proces, der kaldes lithiumplettering. Dette billede viser begyndelsen af plette
Forskere bruger røntgenstråler til at forstå fejlene ved batterihurtig opladningDa lithium-ioner bevæger sig hurtigt mellem elektroderne på et batteri, de kan danne inaktive lag af lithiummetal i en proces, der kaldes lithiumplettering. Dette billede viser begyndelsen af plette -
 Sølvforing til ekstrem elektronikMSU-forskere udviklede en proces til at skabe mere modstandsdygtige kredsløb, hvilket de demonstrerede ved at skabe en sølvfarvet spartansk hjelm. Kredsløbet er designet af Jane Manfredi, en adjunkt v
Sølvforing til ekstrem elektronikMSU-forskere udviklede en proces til at skabe mere modstandsdygtige kredsløb, hvilket de demonstrerede ved at skabe en sølvfarvet spartansk hjelm. Kredsløbet er designet af Jane Manfredi, en adjunkt v -
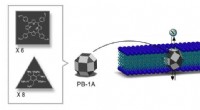 Syntetiske nanokanaler til jodidtransport3-D struktur af den syntetiske iodid-transporter PB-1A udviklet af IBS forskere. PB-1A-design følger formen af 26-sidet polyeder lavet af trekanter og firkanter (mørkegrå) med 12 flader efterladt to
Syntetiske nanokanaler til jodidtransport3-D struktur af den syntetiske iodid-transporter PB-1A udviklet af IBS forskere. PB-1A-design følger formen af 26-sidet polyeder lavet af trekanter og firkanter (mørkegrå) med 12 flader efterladt to -
 Forskere udvikler sig hurtigt, effektiv måde at bygge aminosyrekæder påFra venstre, postdoc forsker Ziyuan Song, professor Jianjun Cheng og kandidatstuderende Tianrui Xue og Lazaro Pacheco, udviklet en ny metode, der strømliner konstruktionen af aminosyrebyggesten, der
Forskere udvikler sig hurtigt, effektiv måde at bygge aminosyrekæder påFra venstre, postdoc forsker Ziyuan Song, professor Jianjun Cheng og kandidatstuderende Tianrui Xue og Lazaro Pacheco, udviklet en ny metode, der strømliner konstruktionen af aminosyrebyggesten, der
- Hvor lang er en soldag på Mars?
- Hvilke to metaller bruges til at danne legering?
- Hvad er indfaldsvinklen, hvis en reflekteret bølge hopper af spejlet ved en 65°?
- Hvordan påvirker brændstof miljøet?
- Facebook fanget i en valgsikkerhed Catch-22
- NASA-data viser, at Californiens San Joaquin Valley stadig synker


