Hvad er en kemisk ændring?
nøglefunktioner ved en kemisk ændring:
* nye stoffer dannes: Atomerne i de originale stoffer omarrangerer og binder forskelligt, hvilket skaber helt nye forbindelser.
* irreversibel (normalt): Mens nogle kemiske ændringer kan vendes, er mange irreversible. Du kan ikke let få de originale stoffer tilbage.
* Energi absorberes eller frigives: Kemiske reaktioner frigiver enten energi (eksotermisk) eller absorberer energi (endotermisk). Dette kan ses som varme, lys eller andre former for energi.
* ofte ledsaget af visuelle ændringer: Du kan se farveændringer, gasproduktion (bobler), dannelse af et bundfald (fast) eller ændringer i lugt.
Eksempler på kemiske ændringer:
* brændende træ: Træ reagerer med ilt, producerer aske, kuldioxid og vand.
* Rusting: Jern reagerer med ilt og vand for at danne jernoxid (rust).
* bagning af en kage: Ingredienserne gennemgår kemiske reaktioner og skaber et nyt stof med en anden struktur, smag og udseende.
* fordøjelse af mad: Din krop nedbryder madmolekyler gennem kemiske reaktioner og frigiver energi og næringsstoffer.
skelnen mellem kemiske ændringer fra fysiske ændringer:
Det er vigtigt at bemærke, at kemiske ændringer adskiller sig fra fysiske ændringer. Fysiske ændringer ændrer kun udseendet eller formen af et stof, ikke dets kemiske sammensætning.
Eksempler på fysiske ændringer:
* Meltis: Vand skifter tilstand fra fast til væske, men det er stadig vand (H2O).
* kogende vand: Vand skifter tilstand fra væske til gas, men det er stadig vand.
* knusning af en dåse: Formen på dåsen ændres, men selve metallet forbliver det samme.
I et nøddeskal skaber en kemisk ændring et nyt stof med forskellige egenskaber, mens en fysisk ændring kun ændrer udseendet eller form.
Sidste artikelEn gas, men ikke en væske kan være en?
Næste artikelHvad (subatomiske partikler) går i midten af atom?
 Varme artikler
Varme artikler
-
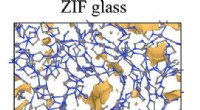 Forudsigelse af egenskaberne af en ny klasse af brillerBeregningsmodel af porøst ZIF-glas. Kredit:Yongjian Yang/Penn State ZIF briller, en ny glasfamilie, kunne kombinere gennemsigtigheden af silikatglas med den ikke-skøre kvalitet af metallisk glas
Forudsigelse af egenskaberne af en ny klasse af brillerBeregningsmodel af porøst ZIF-glas. Kredit:Yongjian Yang/Penn State ZIF briller, en ny glasfamilie, kunne kombinere gennemsigtigheden af silikatglas med den ikke-skøre kvalitet af metallisk glas -
 University of Minnesota rapporterer om gennembrud inden for 3-D-print til reparation af rygmarvenForskere fra University of Minnesota udviklede en prototype af en 3D-printet enhed med levende celler, der kunne hjælpe rygmarvspatienter med at genoprette nogle funktioner. Størrelsen af enheden ka
University of Minnesota rapporterer om gennembrud inden for 3-D-print til reparation af rygmarvenForskere fra University of Minnesota udviklede en prototype af en 3D-printet enhed med levende celler, der kunne hjælpe rygmarvspatienter med at genoprette nogle funktioner. Størrelsen af enheden ka -
 Effekter af tværbinderlængde på anionbyttermembranbrændselscellerFremskridt inden for brændselscelleteknologi vil hjælpe os kraftigt med at reducere vores brug af fossile brændstoffer til at generere elektricitet, fører til mindre luftforurening. Kredit:Chris LeBou
Effekter af tværbinderlængde på anionbyttermembranbrændselscellerFremskridt inden for brændselscelleteknologi vil hjælpe os kraftigt med at reducere vores brug af fossile brændstoffer til at generere elektricitet, fører til mindre luftforurening. Kredit:Chris LeBou -
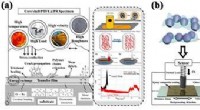 Udvikling af kerne-skal funktionelle kompositter med fremragende selvsmørende egenskaberForberedelse og friktionsoverførselsmekanisme af PTFE-baserede kerne-skal komposit smørematerialer med miljøtilpasning til flere arbejdsforhold. Kredit:LICP I takt med at avanceret mekanisk udstyr
Udvikling af kerne-skal funktionelle kompositter med fremragende selvsmørende egenskaberForberedelse og friktionsoverførselsmekanisme af PTFE-baserede kerne-skal komposit smørematerialer med miljøtilpasning til flere arbejdsforhold. Kredit:LICP I takt med at avanceret mekanisk udstyr


