Hvordan beslutter du, hvilken del af en blanding der er opløsningsmiddel og opløsningsmiddel?
1. Identificer komponenterne:
* opløst: Det stof, der opløses i det andet stof. Det er normalt til stede i et mindre beløb.
* opløsningsmiddel: Det stof, der opløser opløsningen. Det er normalt til stede i et større beløb.
2. Overvej stoftilstanden:
* generel regel: Stoffet i den samme stofstilstand som den endelige opløsning er normalt opløsningsmidlet. For eksempel, hvis du opløser sukker (fast) i vand (væske), er vandet opløsningsmidlet.
* Undtagelser: Nogle gange kan opløsningsmidlet være en gas, som når vi opløser kuldioxid i vand for at fremstille sodavand.
3. Se efter opløsende agent:
* Det stof, der opløses, er opløsningsmidlet. Tænk på det som den "vært", der imødekommer det andet stof.
Eksempler:
* sukker i vand: Sukker er det opløste (faste) og vand er opløsningsmidlet (væske).
* salt i vand: Salt er det opløste (faste) og vand er opløsningsmidlet (væske).
* alkohol i vand: Alkohol er det opløste (væske), og vand er opløsningsmidlet (væske).
* ilt i vand: Oxygen er det opløste (gas), og vand er opløsningsmidlet (væske).
Vigtig note:
* mængden af opløst stof og opløsningsmiddel bestemmer ikke deres identitet. Du kan have en koncentreret løsning med en masse opløst stof eller en fortyndet løsning med lidt opløst stof. Det, der betyder noget, er, at opløsningen opløses i opløsningsmidlet.
* Nogle blandinger kan have flere opløste stoffer og opløsningsmidler. For eksempel har en salt- og sukkeropløsning to opløste stoffer (salt og sukker) opløst i vand (opløsningsmidlet).
Sidste artikelHvad findes der i atomens kerne?
Næste artikelHvordan er et atom i en flydende overførselsvarme?
 Varme artikler
Varme artikler
-
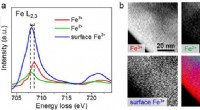 Effektiv brintomdannelse gennem solvandsopdeling ved hjælp af hæmatitmesokrystalbaserede fotoanode…Figur 1:STEM-EELS-analyse viser fordelingen af jernoxid og iltfaciliteter (Vo) i mesokrystaller. (a) EEL (Electron Energy Loss) spektre af Fe L 2, 3 ved hjælp af multivariat analyse. (b) Billede a
Effektiv brintomdannelse gennem solvandsopdeling ved hjælp af hæmatitmesokrystalbaserede fotoanode…Figur 1:STEM-EELS-analyse viser fordelingen af jernoxid og iltfaciliteter (Vo) i mesokrystaller. (a) EEL (Electron Energy Loss) spektre af Fe L 2, 3 ved hjælp af multivariat analyse. (b) Billede a -
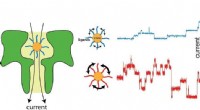 Med nanopore sansning, fysikforskere opdager subtile ændringer i enkelte partiklerResistiv puls nanopore sensing er baseret på ideen om, at små ændringer i strømmen, der bevæger sig gennem en nanopore (grøn, venstre) kan bruges til at lære om molekyler indeholdt. Forskerne var i st
Med nanopore sansning, fysikforskere opdager subtile ændringer i enkelte partiklerResistiv puls nanopore sensing er baseret på ideen om, at små ændringer i strømmen, der bevæger sig gennem en nanopore (grøn, venstre) kan bruges til at lære om molekyler indeholdt. Forskerne var i st -
 3-D print med applikationer i den farmaceutiske industriKredit:CC0 Public Domain University of Sevilla forskere, i samarbejde med University of Nottingham, har formået at skabe det første billede af nanopartikler af stabiliseret guld med biologisk nedb
3-D print med applikationer i den farmaceutiske industriKredit:CC0 Public Domain University of Sevilla forskere, i samarbejde med University of Nottingham, har formået at skabe det første billede af nanopartikler af stabiliseret guld med biologisk nedb -
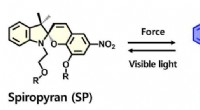 Et materiale der mærker som hudKemisk struktur af spiropyran (SP) mekanoforen og dens transformation til merocyanin (MC) form. Kredit:Korea Institue of Science and Technology (KIST) Menneskelig hud får blå mærker, når væv og mu
Et materiale der mærker som hudKemisk struktur af spiropyran (SP) mekanoforen og dens transformation til merocyanin (MC) form. Kredit:Korea Institue of Science and Technology (KIST) Menneskelig hud får blå mærker, når væv og mu
- Picosecond-elektronoverførsel i peptider kan hjælpe energiteknologier
- Hvilken slags regnskov modtager 200 til 400 centimeter nedbør hvert år?
- Hvilke midler til partikeltransport kræver inputenergi i en celle?
- Definition af Abiotiske ressourcer
- Hvad er delfinerne i kroppen?
- Satellitovervågning for hurtigere, renere forsendelse


