Hvad er en atomkrystall?
Her er nogle nøgleegenskaber ved atomkrystaller:
* stærk limning: De stærke bindinger mellem atomer skaber en stiv, meget stabil struktur. Dette resulterer i høje smelte- og kogepunkter, da der kræves en masse energi for at bryde bindingerne.
* Høj densitet: Den tætte pakning af atomer i krystalstrukturen fører til høj densitet.
* Elektrisk ledningsevne: Atomkrystaller kan udvise en lang række elektriske ledningsevne afhængigt af bindingen af bindingen. Metalliske bindinger giver mulighed for fremragende ledningsevne, mens kovalente bindinger normalt resulterer i isolatorer eller halvledere.
* Termisk ledningsevne: Atomkrystaller er generelt gode termiske ledere på grund af effektiv overførsel af varme gennem gitteret.
* hårdhed: Atomkrystaller kan være meget hårde på grund af de stærke bindinger, der holder atomerne sammen.
Eksempler på atomkrystaller:
* Metaller: Metaller som kobber, guld og sølv form metalliske bindinger, hvilket fører til fremragende elektrisk og termisk ledningsevne samt høj duktilitet og formbarhed.
* diamant: Diamond er en kovalent krystal med stærke, retningsbindinger mellem carbonatomer, hvilket gør det til det sværeste naturligt forekommende materiale.
* silicium: Silicium er et andet eksempel på en kovalent krystal med stærke bindinger mellem siliciumatomer. Det bruges i vid udstrækning i halvlederenheder på grund af dets unikke elektriske egenskaber.
* germanium: I lighed med silicium danner germanium kovalente krystaller og er et andet vigtigt halvledermateriale.
Sammenfattende er atomkrystaller kendetegnet ved stærk binding mellem individuelle atomer, hvilket resulterer i stive strukturer med høj densitet med forskellige egenskaber afhængigt af den tilstedeværende bindingstype. De er vigtige komponenter i mange teknologiske anvendelser, fra elektriske ledere til halvledere og materialer med enestående hårdhed.
 Varme artikler
Varme artikler
-
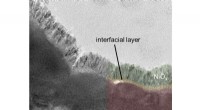 Solbrint:Fotoanoder lover høj effektivitetTEM-billede af en α-SnWO4 film (grøn) overtrukket med 20 nm NiOx (pink). Ved grænsefladen mellem α-SnWO4 og NiOx kan et yderligere grænsefladelag observeres. Kredit:HZB Fotoanoder fremstillet af m
Solbrint:Fotoanoder lover høj effektivitetTEM-billede af en α-SnWO4 film (grøn) overtrukket med 20 nm NiOx (pink). Ved grænsefladen mellem α-SnWO4 og NiOx kan et yderligere grænsefladelag observeres. Kredit:HZB Fotoanoder fremstillet af m -
 Annotationsværktøj giver et skridt i retning af at forstå sammenhænge mellem sygdom, mutant RNADette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia Forskere ved Oregon State University har udviklet et computerprogram, der repræsenterer et vigtigt skridt mod bedre
Annotationsværktøj giver et skridt i retning af at forstå sammenhænge mellem sygdom, mutant RNADette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia Forskere ved Oregon State University har udviklet et computerprogram, der repræsenterer et vigtigt skridt mod bedre -
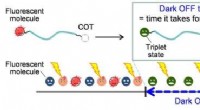 Når FRETING over cancerbiomarkører ikke virker, fokusere på at blinke i stedet forSkematisk repræsentation af fluorescensblink styret af tripletdannelse og triplet-triplet energioverførsel. Kredit:Osaka University Fluorescensspektroskopi er uundværlig i biomedicinsk diagnostik.
Når FRETING over cancerbiomarkører ikke virker, fokusere på at blinke i stedet forSkematisk repræsentation af fluorescensblink styret af tripletdannelse og triplet-triplet energioverførsel. Kredit:Osaka University Fluorescensspektroskopi er uundværlig i biomedicinsk diagnostik. -
 Monsanto mister appel i franske landmænds forgiftningssag (opdatering)Den franske landmand Paul Francois, venstre, og hans advokat Francois Lafforgue på et pressemøde i Lyon, sydøst Frankrig, efter at en appeldomstol stadfæstede hans retssag mod Monsanto over dens Lasso
Monsanto mister appel i franske landmænds forgiftningssag (opdatering)Den franske landmand Paul Francois, venstre, og hans advokat Francois Lafforgue på et pressemøde i Lyon, sydøst Frankrig, efter at en appeldomstol stadfæstede hans retssag mod Monsanto over dens Lasso
- Den elektriske ændring af protoner i kernen er?
- Hvad er neurale celler?
- Hvorfor har alle stjerner brug for brint og helium?
- Sorte mænd har højere tilbagefald på trods af lavere risikofaktorer:undersøgelse
- Pas på katte? Det samme gjorde folk langs Silkevejen for mere end 1.000 år siden
- Fiat Chrysler trykker på Aurora til selvkørende erhvervskøretøjer


