Hvordan handler bicarbonatbuffer?
Kemien:
* bicarbonationer (HCO3-) Vand som en base og accepterer hydrogenioner (H+) for at danne kulsyre (H2CO3).
* kulsyre (H2CO3) , en svag syre, kan donere en hydrogenion (H+) til at blive bicarbonat (HCO3-).
Bufferingshandlingen:
1. Når blodet bliver for surt (pH falder):
* Bicarbonationer (HCO3-) reagerer med de overskydende brintioner (H+) for at danne kulsyre (H2CO3).
* Dette fjerner de overskydende brintioner, reducerer surhedsgraden og øger pH mod normal.
2. Når blodet bliver for alkalisk (pH øges):
* Kulsyre (H2CO3) frigiver en hydrogenion (H+), der bliver bicarbonat (HCO3-).
* Dette tilføjer hydrogenioner, øger surhedsgraden og reducerer pH mod normal.
Lungernes og nyrernes rolle:
* lunger: Lungerne spiller en vigtig rolle i reguleringen af bicarbonatbuffersystemet ved at udvise kuldioxid (CO2). Kulsyre (H2CO3) kan let nedbrydes i vand (H2O) og kuldioxid (CO2). Når vi udånder CO2, skifter vi ligevægten af bicarbonatbuffersystemet, reducerer mængden af kulsyre og reducerer således blodets surhed.
* nyrer: Nyrerne hjælper med at regulere bicarbonatkoncentrationen i blodet ved at reabsorbere bicarbonationer eller udskille dem i urinen. Dette finjusterer buffersystemets evne til at opretholde pH-balance.
Kortfattet:
Bicarbonatbuffersystemet fungerer af:
* reagerer med overskydende brintioner (H+) for at neutralisere surhedsgrad.
* Frigørelse af hydrogenioner (H+) for at neutralisere alkalinitet.
* Arbejder sammen med lungerne og nyrerne for at regulere blodets pH og andre kropsvæsker.
Denne dynamiske proces sikrer et stabilt PH -miljø for kroppen, der er vigtig for korrekt funktion af enzymer og andre vitale processer.
 Varme artikler
Varme artikler
-
 Ny, fuldt bionedbrydelig cellulosemembran viser sig effektiv til olie-vand-separationDen lukkede kredsløbsproces af den nedbrydelige celluloseolie-vand-separationsmembran. Kredit:Institute of Coal Chemistry (CAS) Olieudslip og industriel forurening udgør en enorm trussel mod det øk
Ny, fuldt bionedbrydelig cellulosemembran viser sig effektiv til olie-vand-separationDen lukkede kredsløbsproces af den nedbrydelige celluloseolie-vand-separationsmembran. Kredit:Institute of Coal Chemistry (CAS) Olieudslip og industriel forurening udgør en enorm trussel mod det øk -
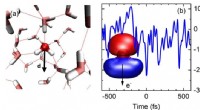 Stærke felter og ultrahurtige bevægelser - hvordan man genererer og styrer elektroner i flydende v…(a) Øjebliksbillede af arrangementet af vandmolekyler i væsken (rød:oxygenatomer, grå; hydrogenatomer). De stiplede linjer angiver hydrogenbindinger mellem molekylerne. Hvert vandmolekyle har et elekt
Stærke felter og ultrahurtige bevægelser - hvordan man genererer og styrer elektroner i flydende v…(a) Øjebliksbillede af arrangementet af vandmolekyler i væsken (rød:oxygenatomer, grå; hydrogenatomer). De stiplede linjer angiver hydrogenbindinger mellem molekylerne. Hvert vandmolekyle har et elekt -
 Enkel metode til at afgøre, om nødder og mejeriprodukter indeholder giftKredit:CC0 Public Domain Forskere ved National Research Nuclear University MEPhI har fundet på en simpel, billig og miljøvenlig metode til at afgøre, om mad indeholder giftig aflatoxin-B1. Resulta
Enkel metode til at afgøre, om nødder og mejeriprodukter indeholder giftKredit:CC0 Public Domain Forskere ved National Research Nuclear University MEPhI har fundet på en simpel, billig og miljøvenlig metode til at afgøre, om mad indeholder giftig aflatoxin-B1. Resulta -
 Video:Hortensia, de mærkelige farveskiftende blomsterKredit:The American Chemical Society Erfarne gartnere ved, at de kan justere farven på hortensiablomster mellem pink og blå ved at ændre jordens pH. Men pH er ikke hele historien. Den kamæleonlig
Video:Hortensia, de mærkelige farveskiftende blomsterKredit:The American Chemical Society Erfarne gartnere ved, at de kan justere farven på hortensiablomster mellem pink og blå ved at ændre jordens pH. Men pH er ikke hele historien. Den kamæleonlig
- Hvad betyder opløsningsmiddelrens?
- Browserværktøj har til formål at hjælpe forskere med at identificere ondsindede websteder, kode
- Nærliggende jordstørrelse Alien World kredser om Stille stjerne,
- Hvilket er ikke en vigtig komponent i naturgas?
- Forskeres innovative oversvømmelseskortlægning hjælper embedsmænd i vand- og beredskabshåndteri…
- Største stjerne i Mælkevejen?


