Hvorfor kan gasser komprimeres?
* store rum mellem molekyler: Der er en masse tomme mellemrum mellem gasmolekyler. Når der påføres tryk, kan molekylerne skubbes tættere sammen og fylde det tomme rum.
* svage intermolekylære kræfter: I modsætning til væsker og faste stoffer er de attraktive kræfter mellem gasmolekyler meget svage. Dette giver dem mulighed for at bevæge sig frit og komprimeres let.
Her er en simpel analogi:
Forestil dig et værelse fyldt med ping pong -kugler. Hvis du skubber på kuglerne, går de tættere sammen og tager mindre plads. Dette svarer til, hvordan gasmolekyler reagerer på tryk.
Faktorer, der påvirker kompressibilitet:
* tryk: Højere tryk kræfter molekyler tættere sammen, hvilket gør gassen mere komprimerbar.
* Temperatur: Højere temperatur øger hastigheden og kinetisk energi af molekyler. Dette gør dem sværere at komprimere, da de modstår at blive skubbet tættere sammen.
Nøglepunkter:
* Væsker og faste stoffer er meget mindre komprimerbare end gasser, fordi deres molekyler er meget tættere sammen.
* Kompressibilitet er en vigtig egenskab i mange applikationer, såsom motorer, pumper og kølesystemer.
Fortæl mig, hvis du gerne vil udforske nogen af disse koncepter mere detaljeret!
Sidste artikelDe fleste faste stoffer er hvad?
Næste artikelHvorfor kaldes vandmolekyler forbindelser?
 Varme artikler
Varme artikler
-
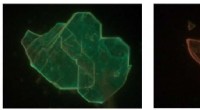 Kamæleonmaterialer:Oprindelsen af farvevariation i lavdimensionelle perovskitterBredfeltsfotoluminescensmikrofotografier (230_175 μm) viser, hvordan nogle Perovskite-flager ser lysegrønne ud over hele deres område (venstre panel), mens andre flager udviser en tydeligt rødforskudt
Kamæleonmaterialer:Oprindelsen af farvevariation i lavdimensionelle perovskitterBredfeltsfotoluminescensmikrofotografier (230_175 μm) viser, hvordan nogle Perovskite-flager ser lysegrønne ud over hele deres område (venstre panel), mens andre flager udviser en tydeligt rødforskudt -
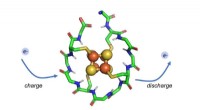 Forskere identificerer protein, der kan have eksisteret, da livet begyndteForskere har designet et syntetisk lille protein, der ombrydes omkring en metalkerne sammensat af jern og svovl. Dette protein kan gentagne gange oplades og udledes, gør det muligt for den at transpor
Forskere identificerer protein, der kan have eksisteret, da livet begyndteForskere har designet et syntetisk lille protein, der ombrydes omkring en metalkerne sammensat af jern og svovl. Dette protein kan gentagne gange oplades og udledes, gør det muligt for den at transpor -
 Forskere kortlægger giftige proteiner forbundet med AlzheimersRashik Ahmed, hovedforfatter og ph.d.-kandidat i Institut for Biokemi og Biomedicinske Videnskaber og Giuseppe Melacini, seniorforfatter og professor i afdelingerne for kemi og kemisk biologi Kredit:G
Forskere kortlægger giftige proteiner forbundet med AlzheimersRashik Ahmed, hovedforfatter og ph.d.-kandidat i Institut for Biokemi og Biomedicinske Videnskaber og Giuseppe Melacini, seniorforfatter og professor i afdelingerne for kemi og kemisk biologi Kredit:G -
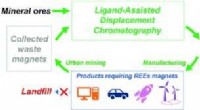 Teknologier til at udvinde, rense kritiske sjældne jordarters metaller kunne være en game changerKredit: Grøn Kemi (2020). DOI:10.1039/D0GC00495B Teknologien – udviklet og patenteret fra Nien-Hwa Linda Wangs laboratorium, Purdues Maxine Spencer Nichols professor i kemiteknik – har med succes
Teknologier til at udvinde, rense kritiske sjældne jordarters metaller kunne være en game changerKredit: Grøn Kemi (2020). DOI:10.1039/D0GC00495B Teknologien – udviklet og patenteret fra Nien-Hwa Linda Wangs laboratorium, Purdues Maxine Spencer Nichols professor i kemiteknik – har med succes
- Hvorfor er formørkelsesstien fra vest til øst?
- Ændringer i læseplanen viser succes efter fjerde år
- Nyt geologisk kort afslører hemmeligheder om Grønlands iskolde indre
- Kinas biludstilling fremhæver industriens elektriske ambitioner
- Hvordan fine bobler fører til mere effektive katalysatorer
- Er der nogen problemer involveret i solenergi?


