Hvad er atomteorien om Neils Bohr?
Niels Bohrs atomteori:Revolutionering af atom
Niels Bohrs atomteori, der blev foreslået i 1913, var en banebrydende fremskridt i vores forståelse af atomet. Det byggede på det eksisterende arbejde i Rutherfords model og indarbejdede ideer fra kvantemekanik for at give en mere nøjagtig beskrivelse af atomstruktur og opførsel. Her er en sammenbrud:
Nøglepunkter for Bohrs atommodel:
1. Bohr foreslog, at elektroner kredsede kernen i specifikke, kvantiserede energiniveauer, hvilket betyder, at de kun kan eksistere i visse diskrete afstande fra kernen. Disse niveauer er mærket som n =1, n =2, n =3, og så videre, med stigende energi, når antallet stiger.
2. Elektroner kan kun hoppe mellem energiniveauet ved at absorbere eller udsende fotoner: En elektron kan flytte fra et lavere energiniveau til et højere niveau ved at absorbere en foton af lys med den nøjagtige energiforskel mellem niveauerne. Omvendt kan en elektron flytte fra et højere energiniveau til et lavere ved at udsende en foton med den samme energiforskel. Dette forklarer de spektrale linjer, der er observeret i atomemissioner.
3. vinkelmomentum er kvantiseret: Bohr foreslog, at vinkelmomentumet for en elektron i en bane også kvantificeres. Dette betyder, at det kun kan påtage sig specifikke diskrete værdier, som er relateret til de tilladte energiniveau.
Hvordan Bohrs model forbedrede sig med Rutherfords:
* forklarede spektrale linjer: Rutherfords model kunne ikke forklare, hvorfor atomer udsendte specifikke bølgelængder af lys (spektrale linjer). Bohrs model behandlede dette ved at foreslå de kvantiserede energiniveau og fotonernes rolle i overgange mellem dem.
* introduceret kvantemekanik: Bohrs model var den første til at inkorporere ideer fra kvantemekanik, hvilket antyder, at elektronernes opførsel i atomer er grundlæggende forskellig fra klassisk fysik.
Begrænsninger af Bohrs model:
* kunne ikke forklare mere komplekse atomer: Mens han var vellykket for brint, kæmpede Bohrs model for nøjagtigt at beskrive atomer med flere elektroner.
* kunne ikke forklare fin struktur af spektrale linjer: Mere detaljerede observationer afslørede, at spektrale linjer faktisk har en fin struktur, som BohR -modellen ikke kunne redegøre for.
* redegjorde ikke for elektronspin: Modellen overvejede ikke den iboende spin af elektroner, som er afgørende for forståelse af atomadfærd.
påvirkning og arv:
På trods af sine begrænsninger revolutionerede Bohrs atomteori vores forståelse af atomet. Det lagde grundlaget for den fremtidige udvikling inden for kvantemekanik og hjalp med at bane vejen for mere sofistikerede modeller som den kvantemekaniske model.
Kortfattet:
Niels Bohrs atomteori bød på en banebrydende forklaring på strukturen og opførslen af atomer, der indeholder kvanteprincipper og tilvejebragte en mere nøjagtig beskrivelse af deres kvantiserede energiniveau og spektrale linjer. Selvom det ikke var perfekt, repræsenterede det et centralt skridt hen imod en mere omfattende forståelse af Atomens verden.
Sidste artikelAtomer har 2 dele, hvad er de, og hvordan er hver enkelt ladet?
Næste artikelHvad er saltvandskorrosion?
 Varme artikler
Varme artikler
-
 Sådan programmeres materialerAli Gooneie ser på en prøve fra sit seneste forskningsprojekt:elektrisk ledende polymerer. De første beregninger til hans næste projekt er skitseret på tavlen. Kredit:Empa Ali Gooneie simulerer på
Sådan programmeres materialerAli Gooneie ser på en prøve fra sit seneste forskningsprojekt:elektrisk ledende polymerer. De første beregninger til hans næste projekt er skitseret på tavlen. Kredit:Empa Ali Gooneie simulerer på -
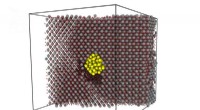 Forskere finder forklaring på unormalt hurtig frigivelse af gas fra atombrændstofEksempel på en beregningscelle:et krystalgitter af urandioxid (grå atomer er uran, røde atomer - ilt) indeholdende en boble af xenon (gule atomer). Uranatomer forskudt til inter-nodale positioner er v
Forskere finder forklaring på unormalt hurtig frigivelse af gas fra atombrændstofEksempel på en beregningscelle:et krystalgitter af urandioxid (grå atomer er uran, røde atomer - ilt) indeholdende en boble af xenon (gule atomer). Uranatomer forskudt til inter-nodale positioner er v -
 Forskere designer en superkatalysator til at producere plastik og brændstoffer uden råolieKredit:Gent Universitet Forskere fra Gent Universitet brugte computersimuleringer til at opdage et nyt materiale, der effektivt producerer kemiske byggesten til brændstof og plast uden at bruge rå
Forskere designer en superkatalysator til at producere plastik og brændstoffer uden råolieKredit:Gent Universitet Forskere fra Gent Universitet brugte computersimuleringer til at opdage et nyt materiale, der effektivt producerer kemiske byggesten til brændstof og plast uden at bruge rå -
 Cellemembran som materiale til knogledannelseForståelse af biologiske fænomener fra en tværfaglig tilgang muliggør udvikling og optimering af bioinspirerede materialer. Kredit:Bioinspired Engineering Udbruddet af celler, der danner brusk, er
Cellemembran som materiale til knogledannelseForståelse af biologiske fænomener fra en tværfaglig tilgang muliggør udvikling og optimering af bioinspirerede materialer. Kredit:Bioinspired Engineering Udbruddet af celler, der danner brusk, er
- Hvorfor falder krummer til jorden på jorden?
- Et hidtil uset blik på oxidgrænseflader afslører uventede strukturer i atomskala
- Hvem lærte, at Jorden er stationær og i midten af universet med Sun Moon -planeter, der bevæger…
- Hvad er en enorm stjerne, der begynder at bruge gasserne i sin kerne?
- Turbolader kontakten til effektive motorer
- 2 Hvad er de fire nitrogenholdige baser for DNA og RNA?


