Hvad har et højere kogepunkt CH3CH3 eller CH3CL?
Her er hvorfor:
* Intermolekylære kræfter: Styrken af intermolekylære kræfter mellem molekyler bestemmer deres kogepunkt. Stærkere intermolekylære kræfter kræver mere energi til at overvinde, hvilket fører til et højere kogepunkt.
* dipol-dipolinteraktioner: CH3CL er et polært molekyle på grund af elektronegativitetsforskellen mellem chlor og kulstof. Dette skaber et permanent dipolmoment, hvilket giver mulighed for dipol-dipolinteraktioner mellem molekyler, som er stærkere end London-spredningskræfterne, der er til stede i den ikke-polære ethan (CH3CH3).
* London Dispersion Forces: Mens begge molekyler udviser London -spredningskræfter, er disse kræfter svagere i ethan på grund af dens mindre størrelse og mindre polariserbarhed.
Kortfattet: De stærkere dipol-dipol-interaktioner i CH3CL sammenlignet med de svagere London-spredningskræfter i CH3CH3 resulterer i et højere kogepunkt for chlormethan.
Sidste artikelHvad er egenskaberne ved gaspartikler?
Næste artikelStort molekyle lavet af flere gentagne enheder?
 Varme artikler
Varme artikler
-
 Undersøgelse afslører korrosionsmekanisme af magnesiumlegeringer i marine atmosfærisk miljøDe optiske fotografier af mikrostruktur for Mg-5Y-1.5Nd-xZn-0.5Zr (x = 0, 2, 4, 6 wt.%) legeringer. Kredit:Journal of Magnesium and Alloys (2022). DOI:10.1016/j.jma.2022.03.007 Magnesiumlegeringer
Undersøgelse afslører korrosionsmekanisme af magnesiumlegeringer i marine atmosfærisk miljøDe optiske fotografier af mikrostruktur for Mg-5Y-1.5Nd-xZn-0.5Zr (x = 0, 2, 4, 6 wt.%) legeringer. Kredit:Journal of Magnesium and Alloys (2022). DOI:10.1016/j.jma.2022.03.007 Magnesiumlegeringer -
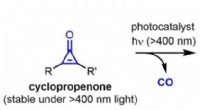 Fotokatalytisk generering af meget reaktive alkyner under synlige lysforholdDen første fotokatalytiske aktive alkyngenerering fra en cyclopropenon under synlige lysforhold er blevet opnået. De genererede aktive alkyner såsom ynamin og cyclooctyne kan anvendes direkte, uden is
Fotokatalytisk generering af meget reaktive alkyner under synlige lysforholdDen første fotokatalytiske aktive alkyngenerering fra en cyclopropenon under synlige lysforhold er blevet opnået. De genererede aktive alkyner såsom ynamin og cyclooctyne kan anvendes direkte, uden is -
 Ny teknologi kan hjælpe med at afvise vand, redde liv gennem forbedret medicinsk udstyrDette billede viser en vanddråbe på en skabt superhydrofob overflade, viser en meget høj kontaktvinkel. Purdue University-forskere udviklede en ny fremstillingsproces til at skabe interne hydrofobe ov
Ny teknologi kan hjælpe med at afvise vand, redde liv gennem forbedret medicinsk udstyrDette billede viser en vanddråbe på en skabt superhydrofob overflade, viser en meget høj kontaktvinkel. Purdue University-forskere udviklede en ny fremstillingsproces til at skabe interne hydrofobe ov -
 Visualisering af varmeflow i bambus kan hjælpe med at designe mere energieffektive og brandsikre by…Kredit:Pixabay Modificerede naturlige materialer vil være en væsentlig komponent i en bæredygtig fremtid, men først er der behov for en detaljeret forståelse af deres egenskaber. Måden varme strøm
Visualisering af varmeflow i bambus kan hjælpe med at designe mere energieffektive og brandsikre by…Kredit:Pixabay Modificerede naturlige materialer vil være en væsentlig komponent i en bæredygtig fremtid, men først er der behov for en detaljeret forståelse af deres egenskaber. Måden varme strøm
- Analyserer vulkaner for at forudsige deres opvågnen
- CO2-emissioner i udviklede økonomier falder på grund af faldende fossilt brændstof og energiforbr…
- Forskere 3-D-printer elektronik og celler direkte på huden
- Hvorfor hjælper hubble-teleskopet os?
- Hvordan rovplankton skabte moderne økosystemer efter Snowball Earth
- 2D organiske materialer:Verdens første syntese af thiophen nanoark med 3,5 nm tykkelse


