Hvordan er sukker- og vandmolekyler ens?
1. Begge er polære molekyler: Dette betyder, at de har en ujævn fordeling af elektrisk ladning. I vand er iltatomet lidt negativt ladet, mens brintatomerne er lidt positivt ladet. I sukkermolekyler er oxygenatomerne også lidt negativt ladede, og kulstof- og brintatomerne er lidt positivt ladede. Denne polaritet giver dem mulighed for at opløses i hinanden.
2. Begge kan danne brintbindinger: De lidt negative iltatomer af begge molekyler kan danne brintbindinger med de lidt positive hydrogenatomer af andre molekyler. Dette er en afgørende faktor i opløsningen af sukker i vand og dannelse af vandige opløsninger.
3. Begge er involveret i vigtige biologiske processer: Vand er vigtigt for livet, og sukker er en primær energikilde for mange organismer.
Her er en sammenbrud af deres forskelle:
* struktur: Sukkermolekyler (såsom glukose) er meget større og mere komplekse end vandmolekyler. De har en ringstruktur med kulstof-, brint- og iltatomer.
* funktion: Vand er et universelt opløsningsmiddel, der er vigtigt for transport af næringsstoffer og fjernelse af affaldsprodukter. Sukker er en energikilde, der giver brændstof til cellulære aktiviteter.
Sammenfattende, mens sukker- og vandmolekyler har forskellige strukturer og funktioner, deler de de vigtige egenskaber ved polaritet og hydrogenbinding, hvilket gør dem i stand til at interagere og spille vigtige roller i biologiske systemer.
Sidste artikelHvad er den kemiske formel for vandfri?
Næste artikelHvordan opløses faste stoffer i væsker?
 Varme artikler
Varme artikler
-
 Bæredygtigt strukturelt materiale til plasterstatningDet cellulose nanofiber-afledte bulk CNFP-strukturmateriale og dets karakterisering. (a) Fotografi af CNFP i stor størrelse med et volumen på 320 × 220 × 27 mm3. (b) CNFPs robuste 3D nanofibernetværk.
Bæredygtigt strukturelt materiale til plasterstatningDet cellulose nanofiber-afledte bulk CNFP-strukturmateriale og dets karakterisering. (a) Fotografi af CNFP i stor størrelse med et volumen på 320 × 220 × 27 mm3. (b) CNFPs robuste 3D nanofibernetværk. -
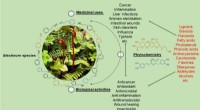 Forskere gennemgår anvendelser, fytokemi og farmakologiske egenskaber af slægten BlechnumMedicinsk anvendte Blechnum-planter. Kredit:WBG Flere værdifulde bregner, der tilhører slægten Blechnum, driver fra gård til traditionel helbredelse og etnofarmakologi, og er potentielle midler til
Forskere gennemgår anvendelser, fytokemi og farmakologiske egenskaber af slægten BlechnumMedicinsk anvendte Blechnum-planter. Kredit:WBG Flere værdifulde bregner, der tilhører slægten Blechnum, driver fra gård til traditionel helbredelse og etnofarmakologi, og er potentielle midler til -
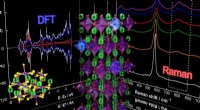 Afkodning af strukturen og egenskaberne af nær-infrarøde reflekterende pigmenterI en ny undersøgelse bruger forskere fra Nagoya Institute of Technology, Japan en kombination af eksperimentelle og teoretiske tilgange til at forstå de optiske, elektroniske og magnetiske egenskaber
Afkodning af strukturen og egenskaberne af nær-infrarøde reflekterende pigmenterI en ny undersøgelse bruger forskere fra Nagoya Institute of Technology, Japan en kombination af eksperimentelle og teoretiske tilgange til at forstå de optiske, elektroniske og magnetiske egenskaber -
 Naturen har mere end én måde at fremstille metan på, siger biokemikereUtah State University biokemikere, fra venstre, Zhi-Yong Yang, Derek Harris, Rhesa Ledbetter og professor Lance Seefeldt, sammen med samarbejdspartnere fra University of Washington og Montana State Un
Naturen har mere end én måde at fremstille metan på, siger biokemikereUtah State University biokemikere, fra venstre, Zhi-Yong Yang, Derek Harris, Rhesa Ledbetter og professor Lance Seefeldt, sammen med samarbejdspartnere fra University of Washington og Montana State Un
- Nogle byer i Californien tror, at de er sikre mod havstigning. De er ikke, viser ny forskning
- Hvad er den faktiske størrelse af mitokondrier?
- Bestemmelse af, hvad der binder til slim
- WAT SALT er ansvarlig for midlertidig og permanent hårdhed af vand?
- LHC begynder at kollidere protonstråler med stråler, der består af tunge ioner
- Hvilket rige klassificerer videnskabsmand Euglena i?


