Kan et stof være både fedtopløseligt og vandopløseligt?
Her er hvorfor:
* opløselighed er baseret på molekylstruktur: Et stofs opløselighed afhænger af tiltrækningen mellem dets molekyler og molekylerne i opløsningsmidlet.
* vand er polært: Vandmolekyler har en positiv og negativ ende (på grund af den ujævne deling af elektroner), hvilket gør det til et polært opløsningsmiddel. Polære molekyler som sukker og salte opløses godt i vand, fordi de kan danne stærke attraktioner med vandmolekylerne.
* fedt er ikke-polære: Fedt og olier består af lange kæder af kulstof- og brintatomer, der deler elektroner jævnt. Dette gør dem til ikke-polære, og de blander sig ikke godt med vand.
* "som opløser som": Den generelle regel er, at polære stoffer opløses i polære opløsningsmidler, og ikke-polære stoffer opløses i ikke-polære opløsningsmidler.
Eksempler:
* olie og vand: Olie er ikke-polær og blandes ikke med vand (som er polær).
* sukker og vand: Sukker er polært og opløser let i vand.
Undtagelser:
* amfipatiske molekyler: Nogle molekyler har både polære og ikke-polære dele. Disse molekyler kan fungere som "broer" mellem vand og fedt, så de kan blande til en vis grad. Eksempler inkluderer sæbe og vaskemidler.
* Miceller: Amfipatiske molekyler kan danne strukturer kaldet miceller i vand. De ikke-polære haler af molekylerne klynger sammen, mens de polære hoveder vender udad og interagerer med vandmolekylerne. Dette gør det muligt for fedt og olier at blive suspenderet i vand.
Kortfattet: Mens nogle stoffer kan være opløselige i både vand og fedt i en lille grad, kan de ikke virkelig være opløselige i begge på samme tid.
 Varme artikler
Varme artikler
-
 Fremtidens plastik vil leve mange tidligere liv takket være kemisk genbrugDetaljebillede af genbrugsplast. Kredit:Patrick Campbell / University of Colorado Boulder En dag i en ikke alt for fjern fremtid kan plastikken i vores satellitter, biler og elektronik alle leve de
Fremtidens plastik vil leve mange tidligere liv takket være kemisk genbrugDetaljebillede af genbrugsplast. Kredit:Patrick Campbell / University of Colorado Boulder En dag i en ikke alt for fjern fremtid kan plastikken i vores satellitter, biler og elektronik alle leve de -
 Stof fundet i fossile brændstoffer kan omdannes til ren diamantYu Lin viser modeller af diamantoider med en, to og tre bure, som kan forvandle sig til det indviklede, rent kulstofgitter af diamant – set i de større, blå model til højre – når den udsættes for ekst
Stof fundet i fossile brændstoffer kan omdannes til ren diamantYu Lin viser modeller af diamantoider med en, to og tre bure, som kan forvandle sig til det indviklede, rent kulstofgitter af diamant – set i de større, blå model til højre – når den udsættes for ekst -
 Billig, ikke-giftig nanofluid kan være en game-changer for olieindvindingKredit:Unsplash/CC0 Public Domain Forskere fra University of Houston har påvist, at en billig og ikke-giftig nanofluid kan bruges til effektivt at genvinde selv tung olie med høj viskositet fra re
Billig, ikke-giftig nanofluid kan være en game-changer for olieindvindingKredit:Unsplash/CC0 Public Domain Forskere fra University of Houston har påvist, at en billig og ikke-giftig nanofluid kan bruges til effektivt at genvinde selv tung olie med høj viskositet fra re -
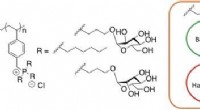 Overraskende antibakteriel aktivitet og selektivitet af hydrofile phosphoniumpolymererKredit:Wiley Kunstige polymerer, ligesom antibiotiske peptider, har brug for både hydrofobe og hydrofile domæner i deres molekylære struktur for at udøve antibakteriel aktivitet. Nu, forskere fra
Overraskende antibakteriel aktivitet og selektivitet af hydrofile phosphoniumpolymererKredit:Wiley Kunstige polymerer, ligesom antibiotiske peptider, har brug for både hydrofobe og hydrofile domæner i deres molekylære struktur for at udøve antibakteriel aktivitet. Nu, forskere fra
- Hvad er det bedste materiale at bruge til en speedbag-platform?
- Mod nanotrådsolceller med en effektivitet på 65 procent
- Afdækning af oprindelsen af galakser glorier
- Kan du forudsige egenskaberne af en forbindelse ved at kende de elementer, der udgør, forklarer dit…
- Hvis et objekt har en masse på 120 g på jorden, hvad ville det så have på månen?
- Hvordan overlever insekter i tropisk klima?


