Hvad er dipolmomentet for thiolforbindelser?
* Polaritet af S-H Bond: Svovl-hydrogen (S-H) -bindingen i en thiol er polær på grund af elektronegativitetsforskellen mellem svovl og brint. Svovl er mere elektronegativ end brint, hvilket betyder, at det tiltrækker de delte elektroner i bindingen stærkere. Dette skaber en delvis negativ ladning (Δ-) på svovl og en delvis positiv ladning (δ+) på brint.
* molekylær geometri: S-H-bindingen er typisk bøjet og bidrager til det samlede dipolmoment.
Faktorer, der påvirker dipolmoment:
* struktur af thiolen: Tilstedeværelsen af andre substituenter på thiolmolekylet kan påvirke dipolmomentet. For eksempel, hvis thiolen er knyttet til en større, mere polær gruppe, vil dipolmomentet være stærkere.
* opløsningsmiddel: Opløsningsmidlet, der omgiver thiolmolekylet, kan også påvirke dets dipolmoment.
Kortfattet: Dipolmomentet af en thiolforbindelse stammer fra den polære karakter af S-H-bindingen og den molekylære geometri. Den specifikke værdi af dipolmomentet vil variere afhængigt af strukturen af thiol og det omgivende miljø.
Sidste artikelNår kaliumhydroxid og bariumchlorid reagerer?
Næste artikelHvad er spredt stof?
 Varme artikler
Varme artikler
-
 Hurtig 3D-print med synligt lysDette komplekse objekt blev 3D-printet på omkring 2,5 timer ved hjælp af synligt lys. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/acscentsci.0c00929 3-D-print har drevet innovatio
Hurtig 3D-print med synligt lysDette komplekse objekt blev 3D-printet på omkring 2,5 timer ved hjælp af synligt lys. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/acscentsci.0c00929 3-D-print har drevet innovatio -
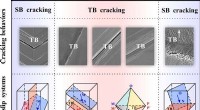 Kan tvillingegrænser modstå træthedsbrud?Træthedsskademekanismer svarende til forskellige hældningsvinkler af CTB og belastningsakse af kobberbikrystal. Kredit:IMR Korngrænser er vidt udbredt i metalliske krystaller og har stor indflydels
Kan tvillingegrænser modstå træthedsbrud?Træthedsskademekanismer svarende til forskellige hældningsvinkler af CTB og belastningsakse af kobberbikrystal. Kredit:IMR Korngrænser er vidt udbredt i metalliske krystaller og har stor indflydels -
 Forskere udvikler en ny heterostrukturkatalysator til effektiv brintgenerering fra vandspaltningAC Transit brint brændselscelle bus. Kredit:Eric Fischer. Bekymringer om stigende atmosfæriske kuldioxidniveauer og global opvarmning har gjort det til en miljømæssig nødvendighed at erstatte fossi
Forskere udvikler en ny heterostrukturkatalysator til effektiv brintgenerering fra vandspaltningAC Transit brint brændselscelle bus. Kredit:Eric Fischer. Bekymringer om stigende atmosfæriske kuldioxidniveauer og global opvarmning har gjort det til en miljømæssig nødvendighed at erstatte fossi -
 Kemikere konverterer plastflaskeaffald til insekticid -sorbentKredit:Tomsk Polytechnic University Forskere fra Tomsk Polytechnic University foreslog en metode til at oprette et sorbent til fjernelse af imidacloprid insekticid fra vand. Sorbenten tilhører met
Kemikere konverterer plastflaskeaffald til insekticid -sorbentKredit:Tomsk Polytechnic University Forskere fra Tomsk Polytechnic University foreslog en metode til at oprette et sorbent til fjernelse af imidacloprid insekticid fra vand. Sorbenten tilhører met
- Elektronprikdiagram til svovl 8 molekyle?
- En motorvej for spin-bølger:Team udvikler proces til styring af innovative informationsmedier
- Sporing af den nordkinesiske leopards potetrin
- Hvilke effekter kan ressourcekonkurrence have på fordelingen af plantearter?
- Snemasseestimater er nu mere pålidelige
- Twitter kan mærke regelovertrædende Trump-tweets


