Hvilke atomer er mest reaktive?
* Meget elektronegativ: Disse atomer har en stærk tiltrækning for elektroner, hvilket gør dem ivrige efter at få elektroner og danne bindinger. Eksempler inkluderer fluor (F) og ilt (O).
* har en enkelt uparret elektron i deres ydre skal: Dette gør dem meget sandsynlige for at reagere med andre atomer for at afslutte deres ydre skal og opnå stabilitet. Eksempler inkluderer brint (H) og halogenerne (F, CL, BR, I).
* har en lav ioniseringsenergi: Disse atomer mister let elektroner og bliver kationer. Eksempler inkluderer alkalimetaller (Li, Na, K, RB, CS).
Her er en sammenbrud af de mest reaktive elementer og deres egenskaber:
* gruppe 1 (alkalimetaller): Disse elementer har kun en valenselektron, hvilket gør dem meget reaktive. De mister let dette elektron for at danne positive ioner (kationer) og reagerer let med vand og andre elementer.
* gruppe 2 (alkaliske jordmetaller): Disse elementer har to valenselektroner og er mindre reaktive end alkalimetaller, men stadig meget reaktive. De danner positive ioner og reagerer med vand, skønt typisk ikke så kraftigt som alkalimetaller.
* gruppe 17 (halogener): Disse elementer har syv valenselektroner, der har brug for en mere for at afslutte deres ydre skal. De er meget reaktive og får let et elektron til dannelse af negative ioner (anioner).
* gruppe 18 (ædelgasser): Disse elementer har en fuld ydre skal af elektroner, hvilket gør dem meget stabile og ureaktive. De findes sjældent i forbindelser.
Generelt stiger reaktiviteten fra højre til venstre og fra top til bund på den periodiske tabel. Dette skyldes, at elementer til venstre har færre valenselektroner og lettere mister dem, mens elementer øverst har færre elektronskaller, hvilket gør det lettere for dem at vinde eller miste elektroner.
Husk: Reaktivitet er et komplekst koncept, der kan påvirkes af forskellige faktorer. Mens ovenstående giver en generel oversigt, kan specifikke reaktioner og reaktiviteten af individuelle elementer variere meget.
Sidste artikelEn enkelt enhed af et stort kulstofbaseret molekyle?
Næste artikelNår kaliumhydroxid og bariumchlorid reagerer?
 Varme artikler
Varme artikler
-
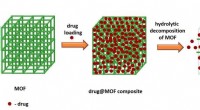 Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu
Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu -
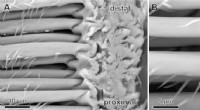 Overraskende opdagelse af edderkoppehår kan inspirere til stærkere klæbemidlerScanning Electron Microscopy (SEM) billede af baserne af pretarsal (dvs. på nederste del af benet) klæbende hår. (A) Til venstre er hårskaftene på de klæbende hår nærmest exoskeleton. Ved deres indsæt
Overraskende opdagelse af edderkoppehår kan inspirere til stærkere klæbemidlerScanning Electron Microscopy (SEM) billede af baserne af pretarsal (dvs. på nederste del af benet) klæbende hår. (A) Til venstre er hårskaftene på de klæbende hår nærmest exoskeleton. Ved deres indsæt -
 Kemisk billeddannelse i stort område afslører originale malingslag på altertavlen i GentKredit:Wiley Betragtes som toppen af middelalderlig maleri, Gent -altertavlen blev malet omkring 1432 af Jan van Eyck og sandsynligvis hans bror Hubert. Det gennemgår i øjeblikket den mest omfat
Kemisk billeddannelse i stort område afslører originale malingslag på altertavlen i GentKredit:Wiley Betragtes som toppen af middelalderlig maleri, Gent -altertavlen blev malet omkring 1432 af Jan van Eyck og sandsynligvis hans bror Hubert. Det gennemgår i øjeblikket den mest omfat -
 Grønt lys for en ny generation af dynamiske materialerForskere ved QUT, UGent og KIT har været banebrydende for et nyt TAD/naphthalen-baseret lysstabiliseret dynamisk materiale, der er stabilt under synligt grønt lys og bliver flydende over tid i mørke.
Grønt lys for en ny generation af dynamiske materialerForskere ved QUT, UGent og KIT har været banebrydende for et nyt TAD/naphthalen-baseret lysstabiliseret dynamisk materiale, der er stabilt under synligt grønt lys og bliver flydende over tid i mørke.
- Hvilken slags bog kan du få på frugt, der fremstiller elektricitet?
- Er lokalsamfund bestående af organismer?
- Over 100 brandforskere opfordrer det amerikanske vest:Spring fyrværkeriet over denne rekordtørre 4…
- Hvilke kroppe cirkler jorden ud over måne?
- What represents the highest energy point on an diagram?
- Opfindelsen af et fleksibelt endoskop, der er tyndere end en nål


