Hvad er den molekylære form af et vandmolekyle, og hvorfor?
* Oxygen's elektronkonfiguration: Oxygen har seks elektroner i sin ydre skal og har brug for to mere for at opnå en stabil oktet.
* Hydrogenbinding: Hvert hydrogenatom deler et elektron med iltatomet, der danner en enkelt kovalent binding.
* Ensomme par: Oxygen har to ensomme par elektroner, der ikke er involveret i binding.
* frastødning: De ensomme par på iltatomet afviser bindingsparene og skubber hydrogenatomerne tættere sammen.
* resulterende form: Denne frastødning skaber en bøjet eller V-form, hvor vinklen mellem de to hydrogenatomer er ca. 104,5 grader.
Kortfattet: De to ensomme par på iltatomet i et vandmolekyle forårsager en betydelig frastødelse, der resulterer i en bøjet molekylær form.
Sidste artikelBeskriv dannelsen af surt regn?
Næste artikelHar molekyler af is mindre masse end vandet?
 Varme artikler
Varme artikler
-
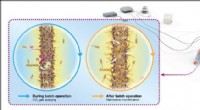 Multifunktionelle porøse ledende membraner hjælper mikrober med at spise sig frem til en hurtigere…Illustration af den mikrobielle elektrosynteseproces, hvorved levende mikrober omdanner kuldioxid til nyttige kemikalier i en elektrokemisk celle via en reduktionsreaktion under påført spænding. Kredi
Multifunktionelle porøse ledende membraner hjælper mikrober med at spise sig frem til en hurtigere…Illustration af den mikrobielle elektrosynteseproces, hvorved levende mikrober omdanner kuldioxid til nyttige kemikalier i en elektrokemisk celle via en reduktionsreaktion under påført spænding. Kredi -
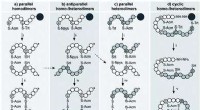 Bioinspirerede strategier til udvikling af nye lægemidlerFig. 1 Syntetiske strategier mod parallelle, antiparallelle og cykliske to-disulfidbindingshomo- og heterodimerer af VP/OT. Anvendte ortogonale beskyttelsesgrupper:Acm, acetamidomethyl; Npys, 3-nitro
Bioinspirerede strategier til udvikling af nye lægemidlerFig. 1 Syntetiske strategier mod parallelle, antiparallelle og cykliske to-disulfidbindingshomo- og heterodimerer af VP/OT. Anvendte ortogonale beskyttelsesgrupper:Acm, acetamidomethyl; Npys, 3-nitro -
 Forskere kontrollerer de elektriske egenskaber af optiske hukommelsesenhederKredit: Journal of Materials Chemistry C (2019). DOI:10.1039/c9tc01273g En gruppe forskere fra Skoltech, Instituttet for problemer med kemisk fysik i RAS, og N.D. Zelinsky Institute of Organic Ch
Forskere kontrollerer de elektriske egenskaber af optiske hukommelsesenhederKredit: Journal of Materials Chemistry C (2019). DOI:10.1039/c9tc01273g En gruppe forskere fra Skoltech, Instituttet for problemer med kemisk fysik i RAS, og N.D. Zelinsky Institute of Organic Ch -
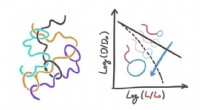 Haletudse på haletudser:Dynamikken i polymerer med en meget unik formDe er født fra foreningen mellem en cirkulær komponent og en lineær komponent og har helt særlige fysiske egenskaber. Under særlige forhold, faktisk, en opløsning af disse molekyler præsenterer sig se
Haletudse på haletudser:Dynamikken i polymerer med en meget unik formDe er født fra foreningen mellem en cirkulær komponent og en lineær komponent og har helt særlige fysiske egenskaber. Under særlige forhold, faktisk, en opløsning af disse molekyler præsenterer sig se
- Fakta om sommerfugleæg
- Forudsiger kort over fare for jordskælv større rystelser, end der faktisk fandt sted? Forskning fi…
- Hvor mange atomer er der i et molekyle af kulilte?
- Hvilken type landform udvikler sig ved pladegrænser i havmagma stiger og smelter?
- Balloner nummer et havrester risiko for dødelighed for havfugle
- Hvilken medicin indeholder planter?


