Hvad er de attraktive kræfter med fast væske og gas?
faste stoffer
* stærkeste attraktive kræfter: Faststoffer har de stærkeste attraktive kræfter mellem deres partikler. Derfor har de en fast form og volumen.
* Typer af kræfter:
* ioniske bindinger: Disse er stærke elektrostatiske attraktioner mellem modsat ladede ioner. (f.eks. bordsalt - NaCl)
* kovalente obligationer: Dette er stærke bindinger, hvor atomer deler elektroner. (f.eks. Diamond - C)
* Metalliske obligationer: Dette involverer et "hav" af delokaliserede elektroner, der deles af alle metalatomer. (f.eks. Kobber - CU)
* Hydrogenbindinger: Speciel type dipol -dipolinteraktion, hvor brint er bundet til et meget elektronegativt atom (f.eks. Vand - H₂O)
* van der Waals Forces: Svage attraktioner mellem molekyler på grund af midlertidige udsving i elektronfordeling (f.eks. Fast iod - I₂)
væsker
* moderate attraktive kræfter: Væsker har svagere attraktive kræfter end faste stoffer, hvilket giver dem mulighed for at flyde og tage formen på deres beholder.
* Typer af kræfter: De samme typer kræfter, der findes i faste stoffer, kan også eksistere i væsker, men de er svagere. Hydrogenbinding og van der Waals kræfter er især vigtige i væsker.
Gasser
* svageste attraktive kræfter: Gasser har de svageste attraktive kræfter mellem partikler. Derfor udvides de til at fylde deres container.
* Typer af kræfter:
* van der Waals Forces: Primært ansvarlig for svage interaktioner mellem gasmolekyler. Disse kræfter bliver mere markante ved lavere temperaturer og højere tryk.
Nøglepunkter:
* Styrke af tiltrækning og tilstand af stof: Styrken af de attraktive kræfter mellem partikler bestemmer stoftilstanden:stærke kræfter =faste, svagere kræfter =væske, meget svage kræfter =gas.
* Temperatur og attraktive kræfter: Stigende temperatur giver mere energi til partikler, hvilket får dem til at bevæge sig hurtigere og svække de attraktive kræfter mellem dem.
* tryk og attraktive kræfter: Stigende tryk kræfter partikler tættere sammen, hvilket øger påvirkningen af attraktive kræfter.
Fortæl mig, hvis du gerne vil have flere detaljer om en bestemt type attraktiv kraft!
Sidste artikelHvad er 2 anvendelser af krystallisation?
Næste artikelHvilken gas reagerer slet ikke den bruges i pærer?
 Varme artikler
Varme artikler
-
 Nyt AI-værktøj beregner materialespænding og -belastning baseret på fotosMIT-forskere har udviklet en maskinlæringsteknik, der bruger et billede af materialets indre struktur til at estimere de spændinger og belastninger, der virker på materialet. Kredit:Massachusetts Inst
Nyt AI-værktøj beregner materialespænding og -belastning baseret på fotosMIT-forskere har udviklet en maskinlæringsteknik, der bruger et billede af materialets indre struktur til at estimere de spændinger og belastninger, der virker på materialet. Kredit:Massachusetts Inst -
 Ny undersøgelse analyserer levedygtigheden af bæredygtige brændstoffer udviklet gennem ny proce…En pilotreaktor, udviklet af Vertimass og placeret hos TechnipFMC, kan opskalere processen, der omdanner ethanol til brændstof, der er egnet til luftfart, forsendelse og andre tunge applikationer. Kre
Ny undersøgelse analyserer levedygtigheden af bæredygtige brændstoffer udviklet gennem ny proce…En pilotreaktor, udviklet af Vertimass og placeret hos TechnipFMC, kan opskalere processen, der omdanner ethanol til brændstof, der er egnet til luftfart, forsendelse og andre tunge applikationer. Kre -
 Ændring af silkeormgener for at forårsage tilsætning af nyttigt protein til silkeproduktionKredit:ACS Et team af forskere med RIKEN Center for Life Science Technologies og National Agriculture and Food Research Organization, både i Japan, har fundet en måde at ændre silkeormgener til at
Ændring af silkeormgener for at forårsage tilsætning af nyttigt protein til silkeproduktionKredit:ACS Et team af forskere med RIKEN Center for Life Science Technologies og National Agriculture and Food Research Organization, både i Japan, har fundet en måde at ændre silkeormgener til at -
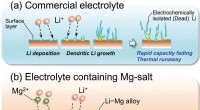 Forskere tager skridt mod sikrere batterier ved at trimme litiumgreneSkematisk illustration af den foreslåede undertrykkende effekt af Li dendritisk vækst ved tilsætning af Mg-salt. Kredit:Royal Society of Chemistry Et samarbejdende team af forskere fra Shinshu Uni
Forskere tager skridt mod sikrere batterier ved at trimme litiumgreneSkematisk illustration af den foreslåede undertrykkende effekt af Li dendritisk vækst ved tilsætning af Mg-salt. Kredit:Royal Society of Chemistry Et samarbejdende team af forskere fra Shinshu Uni
- JPL implementerer en CubeSat til astronomi
- Bryde dårlige metaller med neutroner
- Sådan fungerer metaldetektorer
- Hvad kan din spyt fortælle dig om dit DNA?
- Laboratorieforsøg undersøger dannelsen af stjerner og planeter
- Forståelse af vind og vand ved ækvator er nøglen til mere nøjagtige fremtidige klimafremskrivnin…


