Hvordan er partikler i ilt arrangeret?
* iltgas (O₂): Dette er den form, vi indånder. Det består af to iltatomer kovalent bundet sammen , danner et diatomisk molekyle . Disse molekyler tiltrækkes derefter svagt af hinanden af van der Waals Forces . Dette betyder, at molekylerne er tæt på hinanden, men ikke stift fastgjort i et gitter. De kan bevæge sig frit, hvorfor ilt er en gas ved stuetemperatur.
* fast ilt (O₂): Ved meget lave temperaturer kondenseres iltgas til en væske og derefter længere ind i et fast stof. I fast ilt arrangerer de diatomiske molekyler sig i en krystallinsk gitterstruktur . Der er faktisk flere krystalstrukturer afhængigt af temperaturen og trykket.
Nøgle takeaways:
* iltgas (O₂): Diatomiske molekyler holdt sammen af svage intermolekylære kræfter.
* fast ilt (O₂): Diatomiske molekyler arrangeret i et krystallinsk gitter.
Fortæl mig, hvis du gerne vil vide mere om de specifikke krystalstrukturer af fast ilt!
Sidste artikelHvilken kemikalie smelter isen hurtigst?
Næste artikelHvilke kuglepunkter med surt regn?
 Varme artikler
Varme artikler
-
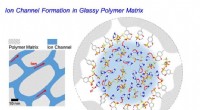 Vil stærk og hurtigt skiftende kunstig muskel være mulig?Skematisk diagram af ionkanaldannelse inde i polymerelektrolytten. Kredit:POSTECH I den amerikanske actionfilm Pacific Rim kæmper gigantiske robotter kaldet Jaegers mod ukendte monstre for at redde
Vil stærk og hurtigt skiftende kunstig muskel være mulig?Skematisk diagram af ionkanaldannelse inde i polymerelektrolytten. Kredit:POSTECH I den amerikanske actionfilm Pacific Rim kæmper gigantiske robotter kaldet Jaegers mod ukendte monstre for at redde -
 Kemisk festende bakterier fjerner sandsynligt kræftfremkaldende stof fra forurenet vandKredit:New Jersey Institute of Technology Selvom det ikke fremgår af de fleste produktingrediensetiketter, den organiske kemiske stabilisator og fremstillingsbiprodukt, 1, 4-dioxan, kan findes i u
Kemisk festende bakterier fjerner sandsynligt kræftfremkaldende stof fra forurenet vandKredit:New Jersey Institute of Technology Selvom det ikke fremgår af de fleste produktingrediensetiketter, den organiske kemiske stabilisator og fremstillingsbiprodukt, 1, 4-dioxan, kan findes i u -
 Optisk keramik møder metal-organiske rammerFor nylig, forskere fra Sun Yat-Sen University rapporterede, at ved blot at sænke opløsningsmidlets fordampningshastighed, metalorganiske nanokrystaller kan smelte sammen ved stuetemperatur for at dan
Optisk keramik møder metal-organiske rammerFor nylig, forskere fra Sun Yat-Sen University rapporterede, at ved blot at sænke opløsningsmidlets fordampningshastighed, metalorganiske nanokrystaller kan smelte sammen ved stuetemperatur for at dan -
 Oprettelse af mønstre spontant i syntetiske materialerEn polymerisationsfront markeret af varmegradienter (rød, højere temperatur) tillader spontan mønsterdannelse af polymerer med variable teksturer, farver og stivhed. Målestok, 1 cm. Kredit:Tilpasset f
Oprettelse af mønstre spontant i syntetiske materialerEn polymerisationsfront markeret af varmegradienter (rød, højere temperatur) tillader spontan mønsterdannelse af polymerer med variable teksturer, farver og stivhed. Målestok, 1 cm. Kredit:Tilpasset f
- Bærbar sundhedsteknologi får effektivitetsopgradering
- Hvad er det lag af jorden, hvor vulkaner forekommer?
- Hvordan en virus krydser din krop, og den gengiver i
- Forskere bruger nanopartikler til at sende kemoterapimedicin direkte til tumorstedet
- Hvad er de forskellige navne på galakser i universet?
- Ret privilegium:Attraktive mennesker anses for at være mere troværdige, bekræfter forskning


