Hvorfor opløses bariumhydroxid i vand, mens magnesium ikke?
opløselighed og ioniske forbindelser
* bariumhydroxid (BA (OH) ₂) er en ionisk forbindelse. Dette betyder, at det danner en krystalgitterstruktur, hvor positivt ladede bariumioner (BA²⁺) og negativt ladede hydroxidioner (OH⁻) holdes sammen af stærke elektrostatiske kræfter.
* vand er et polært opløsningsmiddel. Dette betyder, at dens molekyler har en delvis positiv ladning i den ene ende (brint) og en delvis negativ ladning på den anden (ilt).
* Når BA (OH) ₂ anbringes i vand, omgiver vandmolekylerne ionerne. Den positive ende af vandmolekylet tiltrækker de negativt ladede hydroxidioner (OH⁻), og den negative ende af vandmolekylet tiltrækker de positivt ladede bariumioner (Ba²⁺). Denne proces kaldes hydrering.
* Tiltrækningen mellem vandmolekylerne og ionerne overvinder de elektrostatiske kræfter, der holder BA (OH) ₂ Krystallgitter sammen. Dette gør det muligt for den ioniske forbindelse at opløses, hvilket skaber en opløsning af bariumioner og hydroxidioner i vand.
magnesiummetal (Mg) og reaktivitet
* magnesium er et metal. Metaller har en tendens til at danne metalliske bindinger, hvor elektroner delokaliseres og deles mellem atomer.
* magnesium er mindre reaktiv end barium. Det er mindre sandsynligt, at det danner ioner, og det reagerer ikke let med vand for at producere opløselige forbindelser som barium gør.
* Mens magnesium reagerer med vand, er det en langsom reaktion. Det danner magnesiumhydroxid (Mg (OH) ₂), som er lidt opløselig i vand. Denne reaktion er endnu langsommere ved stuetemperatur og danner et beskyttende lag af magnesiumhydroxid på metaloverfladen, hvilket forhindrer yderligere reaktion.
Kortfattet
Bariumhydroxid opløses i vand, fordi det er en ionisk forbindelse, der let danner hydratiserede ioner, hvilket gør det opløseligt. Magnesiummetal opløses ikke i vand, fordi det er et mindre reaktivt metal, der ikke danner opløselige forbindelser med vand under normale forhold.
 Varme artikler
Varme artikler
-
 Undersøgelse sår tvivl om nøjagtigheden af mobile stoftestanordningerKredit:CC0 Public Domain Ny forskning udført af Lambert Initiative for Cannabinoid Therapeutics ved University of Sydney sætter spørgsmålstegn ved pålideligheden af de to enheder, der i øjeblikk
Undersøgelse sår tvivl om nøjagtigheden af mobile stoftestanordningerKredit:CC0 Public Domain Ny forskning udført af Lambert Initiative for Cannabinoid Therapeutics ved University of Sydney sætter spørgsmålstegn ved pålideligheden af de to enheder, der i øjeblikk -
 Forskere programmerer biomaterialer med logiske porte, der frigiver terapeutika som reaktion på mil…Repræsentation af en simpel JA port. De grå og orange søjler repræsenterer hele porten, som forbinder til polymererne, der holder hydrogel sammen (sorte og lilla bølgede linjer). Porten åbnes - frigiv
Forskere programmerer biomaterialer med logiske porte, der frigiver terapeutika som reaktion på mil…Repræsentation af en simpel JA port. De grå og orange søjler repræsenterer hele porten, som forbinder til polymererne, der holder hydrogel sammen (sorte og lilla bølgede linjer). Porten åbnes - frigiv -
 Kunstig intelligens identificerer den optimale materialeformelEt kig ind i sprutsystemet, hvor nanostrukturerede lag genereres. Kredit:Lars Banko Nanostrukturerede lag kan prale af utallige potentielle egenskaber - men hvordan kan den bedst egnede identifice
Kunstig intelligens identificerer den optimale materialeformelEt kig ind i sprutsystemet, hvor nanostrukturerede lag genereres. Kredit:Lars Banko Nanostrukturerede lag kan prale af utallige potentielle egenskaber - men hvordan kan den bedst egnede identifice -
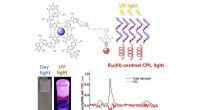 Luminescerende geler til en lang række anvendelser fra forfalskning til bio-sensingGrafisk abstrakt. Kredit:Chem (2022). DOI:10.1016/j.chempr.2022.01.015 Trinity-forskere har hentet inspiration fra naturen til at skabe selvlysende, selvhelbredende geler med en række potentielle a
Luminescerende geler til en lang række anvendelser fra forfalskning til bio-sensingGrafisk abstrakt. Kredit:Chem (2022). DOI:10.1016/j.chempr.2022.01.015 Trinity-forskere har hentet inspiration fra naturen til at skabe selvlysende, selvhelbredende geler med en række potentielle a
- Hvad er P i pH?
- Hvad kaldes det for at bevæge sig opad gennem smalle rør mod tyngdekraften?
- Hvordan beskytter sikringer og afbrydere dig hjem mod elektriske brande?
- De fleste muticellulære organismer vokser og udvikler sig, fordi deres celle fortsætter?
- Hvorfor reagerer jern ikke med kviksølv og danner amalgam?
- Demonstration af kvantekommunikation over optiske fibre over 600 km


