Hvor mange molekyler er der i kobbersulfat?
Her er hvorfor:
* molekylære forbindelser: Dannet ved deling af elektroner mellem ikke -metalatomer. Disse forbindelser findes som diskrete molekyler med et specifikt antal atomer bundet sammen. Eksempler:vand (H₂O), kuldioxid (CO₂).
* ioniske forbindelser: Dannet af den elektrostatiske tiltrækning mellem positivt ladede ioner (kationer) og negativt ladede ioner (ANION). Disse forbindelser findes ikke som individuelle molekyler, men snarere som en tredimensionel gitterstruktur.
kobbersulfat (cuso₄) er en ionisk forbindelse. Det består af kobber (II) -ioner (Cu²⁺) og sulfationer (SO₄²⁻). Når de opløstes i vand, adskiller disse ioner sig og bevæger sig uafhængigt.
Derfor er det ikke meningsfuldt at tale om "molekyler" i kobbersulfat. I stedet taler vi om formelenheden, der repræsenterer det enkleste forhold mellem ioner i forbindelsen.
 Varme artikler
Varme artikler
-
 Nanocontainere til målrettet lægemiddelleveringKredit:RUDN Universitet RUDN University bioingeniører har skabt magnetiske nanocontainere til smart levering af lægemidler til de ønskede organer eller væv, hvilket mindsker risikoen for bivirknin
Nanocontainere til målrettet lægemiddelleveringKredit:RUDN Universitet RUDN University bioingeniører har skabt magnetiske nanocontainere til smart levering af lægemidler til de ønskede organer eller væv, hvilket mindsker risikoen for bivirknin -
 Katalysator fremstillet af jern kan drive en vigtig reaktion for fremstilling af organiske forbindel…Keio University-forskere har fundet en måde at erstatte det dyre ædelmetal ruthenium (billedet) med en simpel jernkatalysator til carbon-hydrogen-alkylering af aromatiske ketoner med alkener. Kredit:S
Katalysator fremstillet af jern kan drive en vigtig reaktion for fremstilling af organiske forbindel…Keio University-forskere har fundet en måde at erstatte det dyre ædelmetal ruthenium (billedet) med en simpel jernkatalysator til carbon-hydrogen-alkylering af aromatiske ketoner med alkener. Kredit:S -
 Små geler opsuger intestinale toksinerMikrogeler er vist ovenfor med sukkermotiver efter binding fluorescensmærkede lektiner. Kredit:Alexander Kuehne Bakterielle infektioner, der er målrettet mod tarmen, kan forårsage tilstande, der s
Små geler opsuger intestinale toksinerMikrogeler er vist ovenfor med sukkermotiver efter binding fluorescensmærkede lektiner. Kredit:Alexander Kuehne Bakterielle infektioner, der er målrettet mod tarmen, kan forårsage tilstande, der s -
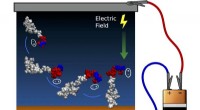 Implanterbart medicinsk udstyr forstærket af næste generations overflademodifikationKontrol af peptidorientering ved hjælp af elektrisk felt. Ladeseparation i den ene ende af peptidet skaber et dipolmoment (angivet med ellipser), der flugter med det elektriske felt og roterer hele mo
Implanterbart medicinsk udstyr forstærket af næste generations overflademodifikationKontrol af peptidorientering ved hjælp af elektrisk felt. Ladeseparation i den ene ende af peptidet skaber et dipolmoment (angivet med ellipser), der flugter med det elektriske felt og roterer hele mo
- Vega-flyvningsmulighed for flere små satellitter
- Hvordan husdyrsystemer fungerer som et reservoir for antimikrobielle resistente bakterier
- Er et videnskabeligt princip taget som sandt?
- Aksymmetriske spidsbølger overskrider langt grænser, der tidligere blev antaget for at diktere den…
- Kvante kropsscanner? Hvad sker der, når vektorhvirvelstråler møder spredningsmedier
- Kostundersøgelse viser begravelsesmåltider af mennesker i Romerriget næsten det samme som daglige…


