Hvad er formlen for et hydrat, der 85,3 procent bariumchlorid og 14,7 vand?
1. Antag en 100 g prøve
* Dette gør beregningerne lettere, da procenterne direkte oversættes til gram.
* Vi har 85,3 g bacl₂ og 14,7 g H₂o.
2. Konverter gram til mol
* bacl₂: (85,3 g bacl₂) / (208,23 g / mol bacl₂) =0,409 mol bacl₂
* h₂o: (14,7 g H₂O) / (18,02 g / mol H₂O) =0,816 mol H₂O
3. Find molforholdet
* Opdel antallet af mol af hver komponent med det mindste antal mol (0,409 mol bacl₂).
* bacl₂: 0,409 / 0,409 =1
* h₂o: 0,816 / 0,409 =2
4. Skriv formlen
Molforholdet fortæller os, at der for hver 1 mol bacl₂ er 2 mol H₂O. Derfor er formlen for hydratet:
bacl₂ ⋅ 2H₂O
Sidste artikelHvor mange carbonatomer indeholder ATP?
Næste artikelHvad bruges svovldioxid til?
 Varme artikler
Varme artikler
-
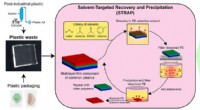 Ny opløsningsmiddelbaseret genbrugsproces kan reducere millioner af tons plastaffaldDen opløsningsmiddel-målrettede genvinding og nedbør (STRAP) proces genbruger flerlags plastaffald til rent, genanvendelige plastmaterialer, såsom polyethylen (PE), ethylenvinylalkohol (EVOH), eller p
Ny opløsningsmiddelbaseret genbrugsproces kan reducere millioner af tons plastaffaldDen opløsningsmiddel-målrettede genvinding og nedbør (STRAP) proces genbruger flerlags plastaffald til rent, genanvendelige plastmaterialer, såsom polyethylen (PE), ethylenvinylalkohol (EVOH), eller p -
 Forskere skaber nye billige, bæredygtigt materiale til reduktion af luft- og vandforureningOversigt over undersøgelsesmetoder og resultater, som viser en ny lavpris, bæredygtigt materiale til reduktion af luft- og vandforurening. Kredit:© 2018 Zanoletti, Vassura, Venturini, Monai, Montini,
Forskere skaber nye billige, bæredygtigt materiale til reduktion af luft- og vandforureningOversigt over undersøgelsesmetoder og resultater, som viser en ny lavpris, bæredygtigt materiale til reduktion af luft- og vandforurening. Kredit:© 2018 Zanoletti, Vassura, Venturini, Monai, Montini, -
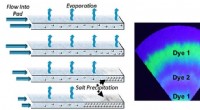 Papirbaseret enhed giver lavt strømforbrug, langsigtet metode til at analysere svedFordampningen af sved på papirpuder kunne bruges til væsketransport i wearables over lange perioder. Det resulterende tørre lag af kagede salte ville bevare en tidsstemplet registrering af biomarkør
Papirbaseret enhed giver lavt strømforbrug, langsigtet metode til at analysere svedFordampningen af sved på papirpuder kunne bruges til væsketransport i wearables over lange perioder. Det resulterende tørre lag af kagede salte ville bevare en tidsstemplet registrering af biomarkør -
 Nøglen til kulfrie biler? Se til stjernerneIllustration af en supernovaeksplosion. Sådanne hvirvlende masser af stof gav form til de tidligste former for kulstof - forstadier til molekyler, som nogle forskere siger, er forbundet med syntesen a
Nøglen til kulfrie biler? Se til stjernerneIllustration af en supernovaeksplosion. Sådanne hvirvlende masser af stof gav form til de tidligste former for kulstof - forstadier til molekyler, som nogle forskere siger, er forbundet med syntesen a


