Nanopartikler giver immunceller et boost
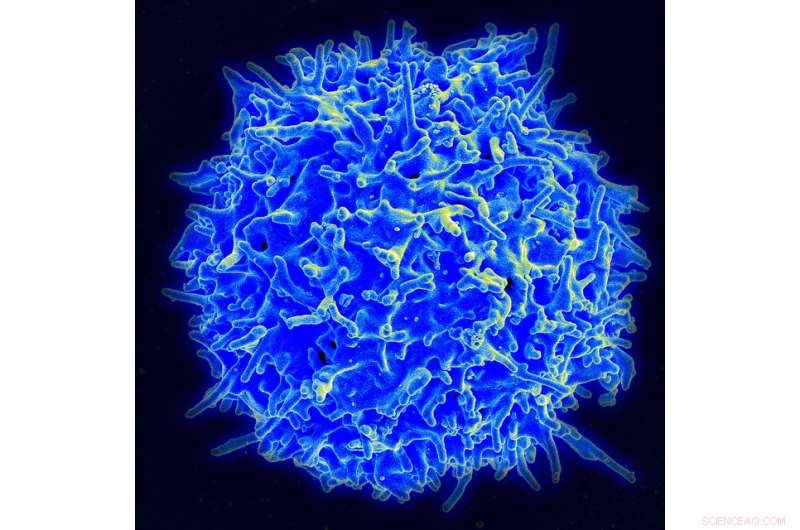
Scanningselektronmikrografi af en human T-lymfocyt (også kaldet en T-celle) fra immunsystemet hos en sund donor. Kredit:NIAID
Programmering af kroppens immunsystem til at angribe kræftceller har haft lovende resultater til behandling af blodkræft såsom lymfom og leukæmi. Denne taktik har vist sig mere udfordrende for solide tumorer såsom bryst- eller lungekræft, men MIT-forskere har nu udtænkt en ny måde at booste immunresponset mod solide tumorer.
Ved at udvikle nanopartikel "rygsække", der rummer immunstimulerende lægemidler, og vedhæfte dem direkte til T-celler, MIT-ingeniørerne viste i en undersøgelse af mus, at de kunne forbedre disse T-cellers aktivitet uden skadelige bivirkninger. Hos mere end halvdelen af de behandlede dyr tumorer forsvandt fuldstændigt.
"Vi fandt ud af, at du i høj grad kunne forbedre effektiviteten af T-celleterapien med medicin i rygsække, der hjælper donor-T-cellerne til at overleve og fungere mere effektivt. Endnu vigtigere, vi opnåede det uden nogen af den toksicitet, som du ser ved systemisk injektion af stofferne, " siger Darrell Irvine, en professor i biologisk ingeniørvidenskab og i materialevidenskab og teknik, medlem af MIT's Koch Institute for Integrative Cancer Research, og den seniorforfatter af undersøgelsen.
Irvine er en af medstifterne af et firma kaldet Torque Biotherapeutics, der planlægger at påbegynde kliniske forsøg med denne tilgang til sommer. Bladets hovedforfattere, som vises i 9. juli-udgaven af Natur bioteknologi , er tidligere MIT postdoc Li Tang, som nu er på det schweiziske føderale institut for teknologi (EPFL), og tidligere MIT-studerende Yiran Zheng.
Udnyttelse af immunsystemet
T-celler er specialiserede immunceller, der strejfer rundt i kroppen, identificere og dræbe inficerede celler. Kræftforskere har længe været fascineret af muligheden for at udnytte disse immunceller til at ødelægge tumorer, gennem en tilgang kaldet adoptiv T-celleterapi. For at opnå dette, forskere skal være i stand til at skabe store populationer af T-celler, der kan genkende og angribe en tumor.
"Den generelle idé er at dyrke et stort antal T-celler, der er tumorspecifikke, og derefter infundere dem i patienter, " siger Irvine.
Forskere har udviklet to primære måder at skabe populationer af T-celler, der kan angribe tumorer. Den ene er at fjerne tumorspecifikke T-celler fra en tumorbiopsi, dyrke dem i en laboratoriefad, og returner dem derefter til patienten. Den anden er at tage cirkulerende T-celler fra patientens blod og enten genetisk modificere dem, så de målretter mod et protein fundet på tumorcellens overflade, eller udsætte dem for tumorproteiner i håb om, at T-cellerne vil blive aktiveret mod disse proteiner.
Disse metoder har vist en vis succes mod lymfomer og leukæmier, men det har vist sig vanskeligt at generere et stærkt immunrespons mod solide tumorer. Forskere har forsøgt at øge responsen på solide tumorer ved at injicere immunstimulerende lægemidler kaldet cytokiner sammen med T-cellerne. Imidlertid, disse lægemidler har skadelige bivirkninger, herunder betændelse, fordi de har tendens til at stimulere enhver T-celle, de støder på. Dette begrænser mængden af lægemiddel, der kan gives.
For at overvinde det, Irvine og hans kolleger har arbejdet på teknikker til kun at stimulere de tumorspecifikke T-celler. I 2010 de rapporterede en måde at gøre dette på ved at fastgøre små kugler kaldet liposomer til de tumor-målrettede T-celler. Disse liposomer bærer en cytokinnyttelast, der kan frigives for kun at stimulere nærliggende T-celler. Imidlertid, partiklerne kunne kun bære en lille mængde af stoffet, og de begyndte at frigive stoffet, så snart T-cellerne blev sprøjtet ind i kroppen.
Til Nature Biotechnology-studiet, forskerne skabte en ny type nanopartikel, der kan bære 100 gange mere af stoffet og ikke frigiver det før efter, at T-cellerne støder på tumoren. Disse partikler består af en gel fremstillet af molekyler af cytokinet IL-15 holdt sammen af en tværbinder, der kun er designet til at nedbrydes, når T-cellen, der bærer partiklerne, når tumoren og bliver aktiveret. Denne aktivering signaleres af en kemisk ændring i overfladen af T-cellerne.
"Det gjorde det muligt for os at koble T-celleaktivering til lægemiddelfrigivelseshastigheden, " siger Irvine. "Nanogelerne opløses fortrinsvis, når T-cellerne er på steder, hvor de ser tumorantigen:i tumoren og i de tumordrænende lymfeknuder. Lægemidlet frigives mest effektivt på de steder, hvor du ønsker det, og ikke i noget sundt væv, hvor det kan forårsage problemer."
Forbedret respons
Forskerne testede denne tilgang i mus, hvis T-celler var gensplejset til at udtrykke en T-celle-receptor, der retter sig mod et protein, der findes i melanom-tumorer. I omkring 60 procent af musene, terapien var så effektiv, at tumorerne forsvandt fuldstændigt efter flere behandlinger. Forskerne viste også, at ved at fæstne nanopartiklerne til menneskelige T-celler, der var genetisk modificeret til at målrette mod glioblastomceller, kunne de dræbe glioblastomceller meget mere effektivt.
Forskerne fandt også ud af, at med nanopartiklerne, de kunne give musene otte gange så meget IL-15 uden bivirkninger, sammenlignet med at injicere stoffet i hele kroppen.
Torque Biotherapeutics, virksomheden, der udfører kliniske forsøg for denne behandling, planlægger at teste det i mange forskellige typer tumorer. Irvine siger, at håbet er, at denne tilgang kan fungere for enhver solid tumor eller blodtumor, så længe der er et kendt mål, der kan programmeres ind i T-cellerne. Han planlægger nu at undersøge, om andre lægemidler end IL-15 kan være endnu mere effektive til at stimulere T-celler.
Sidste artikelManipulering af enkelte atomer med en elektronstråle
Næste artikelCarbon er det nye sort
 Varme artikler
Varme artikler
-
 Fotoelektrode, der kan høste 85 procent af synligt lysTil venstre:Den nyudviklede fotoelektrode, en sandwich af halvlederlag (TiO2) mellem guldfilm (Au -film) og guldnanopartikler (Au NPer). Guldnanopartiklerne blev delvist indlagt på overfladen af tit
Fotoelektrode, der kan høste 85 procent af synligt lysTil venstre:Den nyudviklede fotoelektrode, en sandwich af halvlederlag (TiO2) mellem guldfilm (Au -film) og guldnanopartikler (Au NPer). Guldnanopartiklerne blev delvist indlagt på overfladen af tit -
 Forskning viser, at grafen danner elektrisk ladede rynkerStabler af grafen har en tendens til at danne savtandskrukker, når de komprimeres. Disse rynker har en elektrisk ladning, der kunne være nyttig til at studere DNA eller vejlede selvsamling på nanoskal
Forskning viser, at grafen danner elektrisk ladede rynkerStabler af grafen har en tendens til at danne savtandskrukker, når de komprimeres. Disse rynker har en elektrisk ladning, der kunne være nyttig til at studere DNA eller vejlede selvsamling på nanoskal -
 Ny elektronisk biosensing -teknologi kunne lette en ny æra med personlig medicinDen nye elektroniske mikroplade vises foran den teknologi, den har til formål at erstatte, den konventionelle mikroplade. Kredit:Gary Meek Den flerbrøndede mikroplade, længe et standardværktøj i b
Ny elektronisk biosensing -teknologi kunne lette en ny æra med personlig medicinDen nye elektroniske mikroplade vises foran den teknologi, den har til formål at erstatte, den konventionelle mikroplade. Kredit:Gary Meek Den flerbrøndede mikroplade, længe et standardværktøj i b -
 Kanalisering af valleytronik i grafen:Forskere opdager 1-D-ledende kanaler i to-lags grafenI dette nærfelt infrarøde nanoskopibillede af to-lags grafen opnået ved den avancerede lyskilde, domænevægge afsløres af lyse linjer, der opstår på grund af væggenes elektroniske strukturer og IR -res
Kanalisering af valleytronik i grafen:Forskere opdager 1-D-ledende kanaler i to-lags grafenI dette nærfelt infrarøde nanoskopibillede af to-lags grafen opnået ved den avancerede lyskilde, domænevægge afsløres af lyse linjer, der opstår på grund af væggenes elektroniske strukturer og IR -res


