Hvor mange mol ilt bruges af den komplette forbrændingspropan?
1. Skriv den afbalancerede kemiske ligning:
C₃H₈ (G) + 5O₂ (G) → 3CO₂ (G) + 4H₂O (G)
2. Molforhold:
Den afbalancerede ligning viser, at 1 mol propan (C₃H₈) reagerer med 5 mol ilt (O₂).
3. Beregn molen af ilt:
For at finde molen af ilt, der er nødvendigt til en bestemt mængde propan, ville du bruge følgende:
* mol ilt =(mol propan) x (5 mol o₂ / 1 mol c₃h₈)
Eksempel:
Lad os sige, at du har 2 mol propan. Det nødvendige mol, der kræves, ville være:
* Mol ilt =(2 mol c₃h₈) x (5 mol o₂ / 1 mol c₃h₈) =10 mol o₂
Sidste artikelEr ligningen C3H6 plus O2 -udbytter CO2 H20 afbalanceret?
Næste artikelEt mineral med en hårdhed på 6?
 Varme artikler
Varme artikler
-
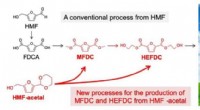 Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli
Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli -
 Fysiker skaber N95-type åndedrætsværn ved hjælp af en bomuldsmaskineKredit:Pixabay/CC0 Public Domain Mahesh Bandi, en fysiker med den ikke-lineære og ikke-ligevægtsfysikenhed, OIST Graduate University, Onna, Okinawa, har fundet en måde at fremstille N95-type respi
Fysiker skaber N95-type åndedrætsværn ved hjælp af en bomuldsmaskineKredit:Pixabay/CC0 Public Domain Mahesh Bandi, en fysiker med den ikke-lineære og ikke-ligevægtsfysikenhed, OIST Graduate University, Onna, Okinawa, har fundet en måde at fremstille N95-type respi -
 Forskere afslører mysteriet om, hvordan stråling svækker metal, ét atom ad gangenDet analyserede GB og dets omgivende miljø. (A) Automatiseret krystalorienteringskortlægning, der viser kornorienteringerne i nærheden af grænsefladen af interesse. Grænsen af interesse adskille
Forskere afslører mysteriet om, hvordan stråling svækker metal, ét atom ad gangenDet analyserede GB og dets omgivende miljø. (A) Automatiseret krystalorienteringskortlægning, der viser kornorienteringerne i nærheden af grænsefladen af interesse. Grænsen af interesse adskille -
 Evaluering af nye behandlingsplatforme til farmaceutisk produktionKredit:Olivia Morales Gonzales Medicinalindustrien er en af de mest relevante sektorer i nutidens økonomi. I mere end et århundrede har den farmaceutiske produktion været afhængig af batchprodukt
Evaluering af nye behandlingsplatforme til farmaceutisk produktionKredit:Olivia Morales Gonzales Medicinalindustrien er en af de mest relevante sektorer i nutidens økonomi. I mere end et århundrede har den farmaceutiske produktion været afhængig af batchprodukt
- Hvorfor er himlen blå?
- Små nanopakker bygget ud af DNA hjælper videnskabsmænd med at se på, hvordan neuroner fungerer
- Moderne havniveaustigning forbundet med menneskelige aktiviteter, Rutgers forskning bekræfter
- Tabletsalg viser friske tegn på afkøling:undersøgelse
- Hvad sker der i planteceller under fotosyntesen?
- Du kan forbedre dine rumlige færdigheder med træning:undersøgelse


