Er Balmer -serien kun til stede i hydrogenatom?
* Balmer -serien og elektroniske overgange: Balmer -serien svarer til elektroniske overgange i et atom, hvor elektronet bevæger sig fra højere energiniveau til det andet energiniveau (n =2). Denne overgang resulterer i emission af lys i det synlige område af det elektromagnetiske spektrum.
* Hydrogens enkelhed: Hydrogen har kun en elektron og en proton, hvilket gør sin elektroniske struktur meget enkel. Denne enkelhed resulterer i veldefinerede energiniveau og en meget fremtrædende Balmer-serie.
* Andre atomer: I andre atomer med flere elektroner er den elektroniske struktur mere kompleks. Energiniveauet påvirkes af elektronelektroninteraktioner, hvilket gør overgange mindre klar. Som et resultat er Balmer -serien i andre atomer svagere og mindre distinkt.
* Lignende serie i andre atomer: Mens Balmer -serien er specifik for overgange til det andet energiniveau, findes andre serier for overgange til forskellige energiniveauer. Disse serier er opkaldt efter deres opdagere, ligesom Lyman -serien (overgange til n =1) og Paschen -serien (overgange til n =3).
Selvom Balmer -serien er mest fremtrædende i brint, kan den også observeres i andre atomer, omend med forskellige grader af prominens.
Sidste artikelHvad er den kemiske formel af svovl tribromid?
Næste artikelHvad er en afbalanceret symbolligning for nitrogenoxid?
 Varme artikler
Varme artikler
-
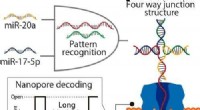 Nanopore-teknologi med DNA-beregning registrerer let mikroRNA-mønstre af lungekræftDNAer genkendte autonomt to mikroRNAer, miR-20a og miR-17-5p, og dannede en fire-vejs forbindelsesstruktur, der blev fanget i nanopore, viser lange blokeringsstrømme. Kredit:Figur tilpasset med tillad
Nanopore-teknologi med DNA-beregning registrerer let mikroRNA-mønstre af lungekræftDNAer genkendte autonomt to mikroRNAer, miR-20a og miR-17-5p, og dannede en fire-vejs forbindelsesstruktur, der blev fanget i nanopore, viser lange blokeringsstrømme. Kredit:Figur tilpasset med tillad -
 Anvendelse af beregningskemi til at simulere realistiske kemiske processerKredit:University of California - San Diego Videnskabens vand er mudret i disse dage - især ved University of California San Diego, hvor alt, der adskiller en kemiker fra en fysiker, i nogle tilfæ
Anvendelse af beregningskemi til at simulere realistiske kemiske processerKredit:University of California - San Diego Videnskabens vand er mudret i disse dage - især ved University of California San Diego, hvor alt, der adskiller en kemiker fra en fysiker, i nogle tilfæ -
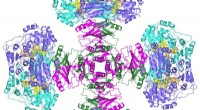 Forskere løser et 50 år gammelt enzymmysteriumKredit:University of Queensland Avancerede herbicider og behandlinger for infektion kan være resultatet af opklaringen af et 50 år gammelt mysterium af forskere fra University of Queensland. Fo
Forskere løser et 50 år gammelt enzymmysteriumKredit:University of Queensland Avancerede herbicider og behandlinger for infektion kan være resultatet af opklaringen af et 50 år gammelt mysterium af forskere fra University of Queensland. Fo -
 Detektering af kemiske midler med tillidEn Joint Chemical Agent Detector udstyret med en tærskelsikkerhedskontrol i sort, På toppen. Kredit:Jason Stoughton/NIST Joint Chemical Agent Detector (JCAD) er blevet et vigtigt forsvarsværktøj p
Detektering af kemiske midler med tillidEn Joint Chemical Agent Detector udstyret med en tærskelsikkerhedskontrol i sort, På toppen. Kredit:Jason Stoughton/NIST Joint Chemical Agent Detector (JCAD) er blevet et vigtigt forsvarsværktøj p
- Hvorfor har fluor en mindre atomradius end både oxygen og klor?
- Ny undersøgelse løser mysteriet om, hvordan bløde væskedråber eroderer hårde overflader
- Sort, Latino-lejere, der er langt mere tilbøjelige til at blive udsat for fordrivelse af boliger un…
- Hvad dannes malmaflejringer af?
- Elske eller dræbe din næste? Ny undersøgelse af dyrs social adfærd
- Hvad er Safranin -løsning inden for videnskab?


