Hvilke bindinger viser mindst ionisk karakter NaCl HCL OCL eller BRCL?
Forståelse af ionisk karakter
Ionisk karakter henviser til den grad, i hvilken en binding er polær. En polær binding betyder, at elektronerne ikke deles lige mellem atomerne, hvilket skaber en delvis positiv ladning på det ene atom og en delvis negativ ladning på den anden.
Faktorer, der påvirker ionisk karakter:
* Elektronegativitetsforskel: Jo større forskellen i elektronegativitet mellem to atomer, jo mere ionisk er bindingen. Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner.
* Periodiske tendenser: Elektronegativitet øges generelt fra venstre til højre over en periode og falder ned ad en gruppe i den periodiske tabel.
analyse af obligationerne:
1. NaCl: Natrium (NA) er et metal, og chlor (CL) er en ikke -metal. Metaller har lav elektronegativitet, og ikke -metaller har høj elektronegativitet. Denne store elektronegativitetsforskel gør NaCl meget ionisk.
2. hcl: Hydrogen (H) har en elektronegativitet på 2,1, og chlor (CL) har en elektronegativitet på 3,0. Forskellen er betydelig, hvilket gør HCL -polær kovalent, men stadig med betydelig ionisk karakter.
3. ocl: Oxygen (O) har en elektronegativitet på 3,5, og chlor (CL) har en elektronegativitet på 3,0. Forskellen er mindre end i HCL, hvilket fører til en mere kovalent binding.
4. brcl: Brom (BR) har en elektronegativitet på 2,8, og chlor (CL) har en elektronegativitet på 3,0. Dette er den mindste elektronegativitetsforskel, hvilket resulterer i den mest kovalente binding (mindst ionisk karakter) blandt indstillingerne.
Konklusion
Bindingen med den mindst ioniske karakter er brcl . Dette skyldes, at forskellen i elektronegativitet mellem brom og klor er den mindste.
Sidste artikelHvad er formlen for natriumkaliumsulfat?
Næste artikelHvad er reaktionen, der involverer forbrænding af brint?
 Varme artikler
Varme artikler
-
 Gennemgang af den seneste udvikling inden for elektrolyse af saltvandKredit:CC0 Public Domain Solcelledrevet teknologi, såsom fotovoltaik (PVer), kunne løse nogle af vores tids miljøudfordringer, muliggør bæredygtig produktion af elektrisk energi i mange geografisk
Gennemgang af den seneste udvikling inden for elektrolyse af saltvandKredit:CC0 Public Domain Solcelledrevet teknologi, såsom fotovoltaik (PVer), kunne løse nogle af vores tids miljøudfordringer, muliggør bæredygtig produktion af elektrisk energi i mange geografisk -
 Lys kan bruges til at kontrollere genfunktionenOptogenetics anvender metoder, hvor lys kan bruges til at styre cellulære funktioner. Kredit:Jari Rossi Lys kan bruges som en nøjagtig metode til at kontrollere genekspression, viser banebrydende
Lys kan bruges til at kontrollere genfunktionenOptogenetics anvender metoder, hvor lys kan bruges til at styre cellulære funktioner. Kredit:Jari Rossi Lys kan bruges som en nøjagtig metode til at kontrollere genekspression, viser banebrydende -
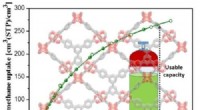 Naturgas kunne bygge bro mellem benzin og elektriske køretøjer takket være metal-organiske rammerLovende MOFer blev identificeret beregningsmæssigt og demonstrerer eksperimentelt bemærkelsesværdig metanoptagelse, der overgår kendte benchmarks både volumetrisk og gravimetrisk. Avanceret sæt af int
Naturgas kunne bygge bro mellem benzin og elektriske køretøjer takket være metal-organiske rammerLovende MOFer blev identificeret beregningsmæssigt og demonstrerer eksperimentelt bemærkelsesværdig metanoptagelse, der overgår kendte benchmarks både volumetrisk og gravimetrisk. Avanceret sæt af int -
 Det nye grønne alternativ til medicinproduktionStruktur af den aktive mangankatalysator i vand. Kredit:Universitetet i Göttingen De fleste af processerne til fremstilling af lægemidler, pesticider og smartphone-skærme er omkostningstunge og ge
Det nye grønne alternativ til medicinproduktionStruktur af den aktive mangankatalysator i vand. Kredit:Universitetet i Göttingen De fleste af processerne til fremstilling af lægemidler, pesticider og smartphone-skærme er omkostningstunge og ge
- Hvilke stoffer er reaktant i fotosyntesen?
- 30 dræbt, da skovbrande raser i Portugal og Spanien
- Billede:Hubble spionerer galaktisk trafikprop
- Mursten for mursten, en løsning, der søger at vælte vejspærringen for energilagring
- Evolutionsbiologer viser, at hungøgens farvevarianter er baseret på gamle mutationer
- Hvad er poenget med indgangskarbondioxid i indvendige bladeplante?


