Når calciummetal reagerer med iltgas i luften for at danne oxid Antag, at du reagerer 6,55 mol 4,00 nu bestemmer antal producerede mol?
1. Den afbalancerede kemiske ligning
Reaktionen mellem calcium (Ca) og ilt (O₂) producerer calciumoxid (CAO):
2 CA + O₂ → 2 CAO
Denne ligning fortæller os, at 2 mol calcium reagerer med 1 mol ilt for at producere 2 mol calciumoxid.
2. Identificering af den begrænsende reaktant
Vi er nødt til at finde ud af, hvilken reaktant, calcium eller ilt, løber ud først. Dette kaldes den begrænsende reaktant, og det bestemmer, hvor meget produkt vi kan fremstille.
* mol calcium: 6,55 mol
* mol ilt: 4,00 mol
For at sammenligne dem bruger vi molforholdet fra den afbalancerede ligning:
* For hver 2. mol Ca har vi brug for 1 mol o₂.
Lad os se, om vi har nok ilt til, at al calcium reagerer:
* Vi har 6,55 mol Ca, som kræver (6,55 mol Ca / 2) * 1 mol O₂ =3,275 mol O₂.
Da vi har 4,00 mol O₂, har vi nok ilt til at reagere med al calcium. Dette betyder, at calcium er den begrænsende reaktant.
3. Beregning af mol af calciumoxid
Ved hjælp af den begrænsende reaktant (calcium) kan vi finde molen for produceret calciumoxid:
* molforholdet er 2 mol CA:2 mol Cao
Derfor vil 6,55 mol Ca producere 6,55 mol Cao.
Svar: 6,55 mol calciumoxid (CAO) vil blive produceret.
 Varme artikler
Varme artikler
-
 En ny fluorescerende probe, der kan skelne B-celler fra T-cellerFigur 1. A) Splenocytter blev isoleret fra musemilt, og T- og B -celler blev adskilt ved anvendelse af magnetisk aktiveret cellesortering (MACS). Cellerne blev efterfølgende udpladet i 384 brønde og o
En ny fluorescerende probe, der kan skelne B-celler fra T-cellerFigur 1. A) Splenocytter blev isoleret fra musemilt, og T- og B -celler blev adskilt ved anvendelse af magnetisk aktiveret cellesortering (MACS). Cellerne blev efterfølgende udpladet i 384 brønde og o -
 Slut med at lege med ilden:Studiet giver indsigt i sikrere genopladelige batterierLithiumdendritter aflejret på overfladen af carbonelektroden detekteres ved hjælp af nuklear magnetisk resonans (NMR) analyse. Mængden af aflejret lithiumdendrit estimeres kvantitativt ud fra 7Li
Slut med at lege med ilden:Studiet giver indsigt i sikrere genopladelige batterierLithiumdendritter aflejret på overfladen af carbonelektroden detekteres ved hjælp af nuklear magnetisk resonans (NMR) analyse. Mængden af aflejret lithiumdendrit estimeres kvantitativt ud fra 7Li -
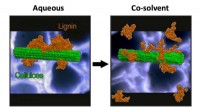 Supercomputing forbedrer biomassebrændstofkonverteringCo-opløsningsmidler THF og vand får lignin til at adskille sig fra sig selv og cellulose, udvides til en tilfældig spole. Kredit:Charles Cai/UCR Brændstoffer fremstillet af landbrugs- eller skovbr
Supercomputing forbedrer biomassebrændstofkonverteringCo-opløsningsmidler THF og vand får lignin til at adskille sig fra sig selv og cellulose, udvides til en tilfældig spole. Kredit:Charles Cai/UCR Brændstoffer fremstillet af landbrugs- eller skovbr -
 Katalysering af en kulstoffri verden ved at høste energi fra levende cellerKrebs cyklus metabolitter falder i energirigt kulstofråmateriale, Kredit:Issey Takahashi Den forestående miljøkrise kræver en hurtig overgang til en grøn økonomi. Et team af videnskabsmænd ved Nag
Katalysering af en kulstoffri verden ved at høste energi fra levende cellerKrebs cyklus metabolitter falder i energirigt kulstofråmateriale, Kredit:Issey Takahashi Den forestående miljøkrise kræver en hurtig overgang til en grøn økonomi. Et team af videnskabsmænd ved Nag
- Hvad vil der ske, hvis du putter fire forskellige mynte i væsker?
- Hvordan er overfladen af måne?
- Forskere fremskynder metode til opdagelse af lægemidler via zombie-lignende celler
- Hvad er 24 5 tommer i millimeter?
- Hvordan ser neutronstjerner ud, og hvordan deres unikke egenskaber bidrager til udseende i universet…
- Genbrug Vs. Deponeringsanlæg eller forbrændingsanlæg


