En ny fluorescerende probe, der kan skelne B-celler fra T-celler
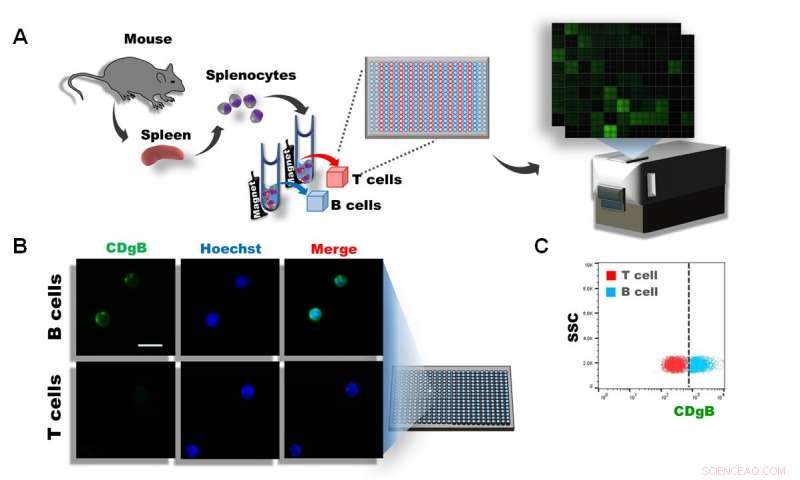
Figur 1. A) Splenocytter blev isoleret fra musemilt, og T- og B -celler blev adskilt ved anvendelse af magnetisk aktiveret cellesortering (MACS). Cellerne blev efterfølgende udpladet i 384 brønde og over 10, 000 forskellige fluorescerende molekyler blev screenet under anvendelse af DOFLA. B) Fluorescensmikroskopbillede viser, at CDgB pletter B -celler, men ikke T -celler. C) Flowcytometrigraf af CDgB-fluorescens vs SSC mellem T-celle- og B-cellepopulationer. Kredit:Institut for Grundvidenskab
Menneskeblod indeholder flere forskellige komponenter, inklusive plasma, røde blodlegemer (RBC'er), hvide blodlegemer (WBC'er), og blodplader. Imellem disse, WBC'er er opdelt i adskillige underkategorier, hver med unikke funktioner og egenskaber, såsom lymfocytter, monocytter, neutrofiler, og andre. Lymfocytter er yderligere opdelt i T-lymfocytter, B-lymfocytter, og NK-celler. At skelne og adskille forskellige typer af disse celler er meget vigtigt ved udførelse af undersøgelser inden for immunologi.
Diskriminering af forskellige immuncelletyper sker typisk ved flowcytometri og fluorescensaktiveret cellesortering (FACS), som kan identificere forskellige populationer af celler i henhold til deres størrelse, granularitet, og fluorescens. Mens størrelse og granularitet alene ikke kan skelne celler med lignende fysiske parametre, Forskellige typer immunceller udviser en særskilt kombination af immunreceptorer på celleoverfladerne. For eksempel, T -lymfocytterne og B -lymfocytterne udtrykker CD3 og CD19, henholdsvis. Derfor, fluorescerende identificerende immunceller har været afhængige af farvning af cellerne ved hjælp af flere antistoffer mod forskellige receptorer. Man har længe troet, at det var umuligt at skelne forskellige immuncelletyper uden at bruge disse antistoffer.
Imidlertid, ny banebrydende forskning udført af forskerne ved Center for Selvsamling og kompleksitet i Institut for Grundvidenskab, Sydkorea, måske lige har ændret dette. Forskerne brugte en diversitetsorienteret fluorescensbibliotekstilgang (DOFLA) til at screene over 10, 000 forskellige fluorescerende molekyler ved hjælp af B- og T-lymfocytter adskilt fra musemilt. Fra dette, det lykkedes dem at opdage en ny fluorescerende sonde, der kan skelne B -lymfocytter frem for T -lymfocytter uden at celleceptoren målretter antistoffer.
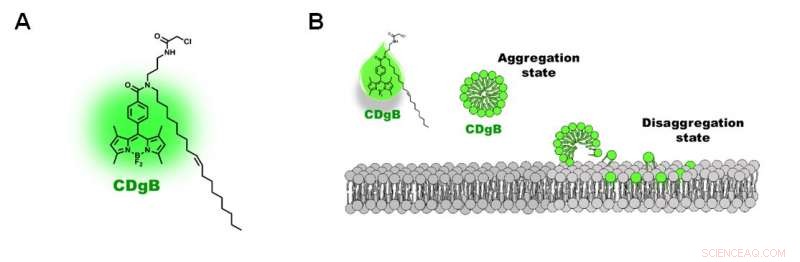
Figur 2. A) Struktur af CDgB -molekyle. B) Fri ubundet CDgB danner aggregater i opløsning, som dissocierer, når de binder sig til lipidmembraner. Kredit:Institut for Grundvidenskab
Forskerne kaldte den nye sonde for CDgB, som står for Compound of Designation grøn for B-lymfocytter. CDgB er et lipofilt molekyle, der indeholder en fluorescerende komponent bundet til en carbonhydridkæde. Da CDgB både indeholder en polær fluorescerende gruppe og en kulbrintehale, det betyder, at de frie ubundne CDgB-farvestofmolekyler danner aggregater svarende til miceller i opløsningen og udviser et lavt niveau af baggrundsfluorescens. Når de binder sig til celleoverfladerne, imidlertid, aggregaterne dissocierer og forårsager en stigning i fluorescenssignaler. Ud over, farvestoffets lipofile beskaffenhed betyder, at farvestoffet ikke binder sig til et proteinmål, og i stedet lokaliseres til lipidmembranstrukturen direkte. Ifølge forskerne, dette var "det første eksempel, der rapporterede en sådan type celledistinktionsmekanisme."
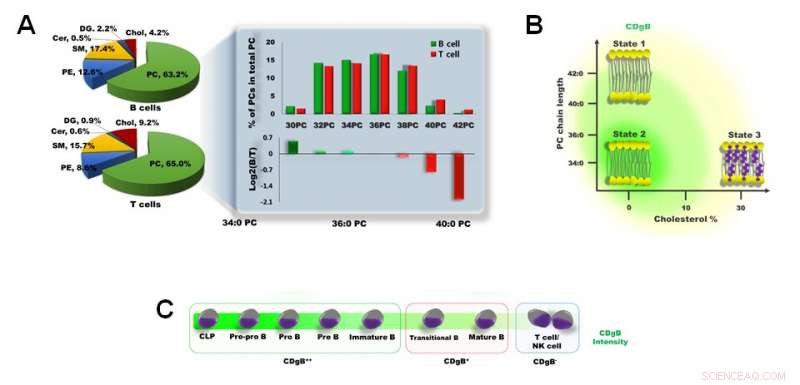
Figur 3. A) Forskel i membranlipidsammensætning mellem B-celler og T-celler. B) CDgB farver selektivt lipidmembraner af B-celler, som har kortere PC-kædelængde og en lavere procentdel af kolesterol. C) CDgB viser højere fluorescens i umodne B-celler (CDgB++) end i modne B-celler (CDgB+) eller andre lymfocytter (CDgB-). Kredit:Institut for Grundvidenskab
CDgB er i stand til selektivt at målrette cellemembranerne af B-lymfocytter over T-lymfocytter eller NK-celler. Forskerne søgte at optimere selektiviteten af CDgB ved at teste forskellige derivater af molekylerne med forskellige carbonhydridkædelængder fra 4 til 20 carbonatomer. Det blev fundet, at CDgB -derivaterne med 14 til 18 carbonatomer viste den højeste selektivitet over for B -lymfocytter, med C18, der viser de bedste resultater. Det blev sværere at skelne cellerne gennem fluorescens, når kulstoflængden blev øget ud over 20. Det faktum, at kulstoflængden har betydning for selektiviteten, antydede, at mekanismen var afhængig af forskellen i membranstrukturerne mellem B- og T-lymfocytter.
Forskerne belyste yderligere denne mekanisme ved at udføre lipidomanalyse af B- og T-cellemembraner. Phosphatidylcholin (PC) udgør størstedelen (> 60%) af membranphospholipiderne i både B- og T -lymfocytter. Det blev fundet, at B-lymfocytter generelt havde kortere PC'er end T-lymfocytternes. Ud over, membrankolesterolindholdet i T-lymfocytterne var omkring to gange højere end i B-lymfocytter. Disse faktorer giver B-lymfocytterne en mere 'fleksibel' cellemembran, hvilket man mente var en afgørende faktor, der forklarer, hvorfor CDgB-molekylerne hæfter sig lettere til B-lymfocytternes cellemembraner end T-lymfocytternes. Selv blandt B-lymfocytterne, det blev fundet, at styrken af fluorescensen var forskellig baseret på cellemodenheden. B-celle-progenitorerne og umodne B-celler afgav meget lysere fluorescenssignaler end modne B-celler, hvilket højst sandsynligt skyldes den højere membranfleksibilitet i de umodne celler.
Forskerne konkluderede desuden, at denne nye lipid-orienterede levende celle-distinction-mekanisme (LOLD) kan supplere den eksisterende celle-distinction-mekanisme for at forbedre vores evne til at skelne specifikke celletyper fra komplicerede blandinger af forskellige celler. Denne forskning blev offentliggjort i Journal of the American Chemical Society .
 Varme artikler
Varme artikler
-
 Hvordan rentvandsteknologier kunne få et løft fra røntgensynkrotronerKredit:George Hodan/public domain Verden har brug for rent vand, og dets behov vil kun vokse i de kommende årtier. Alligevel er afsaltning og andre vandrensende teknologier ofte dyre og kræver meg
Hvordan rentvandsteknologier kunne få et løft fra røntgensynkrotronerKredit:George Hodan/public domain Verden har brug for rent vand, og dets behov vil kun vokse i de kommende årtier. Alligevel er afsaltning og andre vandrensende teknologier ofte dyre og kræver meg -
 Fra bånd til rulning:Få formkontrol ved elektrostatikC16-K1 samling billeder, der viser høje aspekt transformationer til cochleate med stigende saltkoncentration. Kredit:Northwestern University Northwestern Engineering materialevidenskabelige forske
Fra bånd til rulning:Få formkontrol ved elektrostatikC16-K1 samling billeder, der viser høje aspekt transformationer til cochleate med stigende saltkoncentration. Kredit:Northwestern University Northwestern Engineering materialevidenskabelige forske -
 Rød fluorescens i to trinEn modificeret type af Eos-proteinet kan fås til at fluorescere, når den belyses med blåt og rødt laserlys. Baggrund:to proteiner i cytoskelettet i blåt og rødt. Proteinet synligt i rødt blev mærket m
Rød fluorescens i to trinEn modificeret type af Eos-proteinet kan fås til at fluorescere, når den belyses med blåt og rødt laserlys. Baggrund:to proteiner i cytoskelettet i blåt og rødt. Proteinet synligt i rødt blev mærket m -
 Forskere finder nøglen til at bevare SkrigetSkriget (1910?) (Munch Museum, Oslo; katalog n. Woll.M.896). Kredit:Irina Crina Anca Sandu og Eva Storevik Tveit, Munch Museum. Skriget er blandt de mest berømte malerier i den moderne æra. Det ve
Forskere finder nøglen til at bevare SkrigetSkriget (1910?) (Munch Museum, Oslo; katalog n. Woll.M.896). Kredit:Irina Crina Anca Sandu og Eva Storevik Tveit, Munch Museum. Skriget er blandt de mest berømte malerier i den moderne æra. Det ve
- Bevaringsforkæmpere finder, at beskyttede områder på verdensplan krymper
- Sådan beregnes prøveformat fra et tillidsinterval
- Storbritanniens bilproduktion kollapser på grund af Brexit uden aftale:industri
- Relikvier fra Shakespeares hjem deles i ny virtuel udstilling
- Dele af Wisconsin, Illinois komme sig efter oversvømmelser
- Prøv disse 5 daglige vaner for at forbedre dit liv i år


