Hvilken masse brintgas produceres, når der opløses en 7,35 g -chunk -zink i 500 ml 1,2 M HCI?
1. Skriv den afbalancerede kemiske ligning
Reaktionen mellem zink og saltsyre producerer zinkchlorid og brintgas:
Zn (S) + 2HCI (aq) → Zncl₂ (aq) + H₂ (g)
2. Bestem den begrænsende reaktant
* mol zink:
- Molmasse Zn =65,38 g/mol
- mol Zn =(7,35 g) / (65,38 g / mol) =0,112 mol
* mol HCL:
- Molaritet af HCL =1,2 m (mol/liter)
- volumen HCI =500 ml =0,5 l
- mol HCl =(1,2 mol/l) * (0,5 l) =0,6 mol
* støkiometri:
- Den afbalancerede ligning viser, at 1 mol Zn reagerer med 2 mol HCI.
- Vi har 0,112 mol Zn, som kræver 0,224 mol HCI. Da vi har 0,6 mol HCI, er HCl i overskud, og zink er den begrænsende reaktant.
3. Beregn massen af brintgas produceret
* mol brint:
- Den afbalancerede ligning viser, at 1 mol Zn producerer 1 mol H₂.
- Derfor vil 0,112 mol Zn producere 0,112 mol H₂.
* Mass af brint:
- Molmasse af H₂ =2,016 g/mol
- Masse H₂ =(0,112 mol) * (2,016 g/mol) =0,226 g
Svar: Cirka 0,226 gram brintgas vil blive produceret.
Sidste artikelHvilken type reaktion er kaliumpermangante?
Næste artikelEr en hydrogenion negativt ladet atom?
 Varme artikler
Varme artikler
-
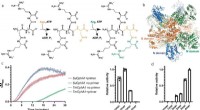 De overraskende schweizerkniv-lignende funktioner af et kraftfuldt enzymCphA1 struktur og aktivitet. a Skematisk diagram af de biosyntetiske reaktioner katalyseret af G- og M-domænerne af CphA1. b Den overordnede struktur af tetramer CphA1 fra Synechocystis sp. UTEX2470 (
De overraskende schweizerkniv-lignende funktioner af et kraftfuldt enzymCphA1 struktur og aktivitet. a Skematisk diagram af de biosyntetiske reaktioner katalyseret af G- og M-domænerne af CphA1. b Den overordnede struktur af tetramer CphA1 fra Synechocystis sp. UTEX2470 ( -
 Hvordan kan forskere hurtigt få adgang til komplekse molekyler til lægemiddelopdagelse?Kredit:Pixabay/CC0 Public Domain Funktionen af molekyler, der bruges i lægemidler, afhænger delvist af deres struktur, herunder de mange kemiske bindinger mellem deres atomer. Disse molekyler ka
Hvordan kan forskere hurtigt få adgang til komplekse molekyler til lægemiddelopdagelse?Kredit:Pixabay/CC0 Public Domain Funktionen af molekyler, der bruges i lægemidler, afhænger delvist af deres struktur, herunder de mange kemiske bindinger mellem deres atomer. Disse molekyler ka -
 Virus skelner, ødelægge E. coli i drikkevandEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH For hurtigt at opdage tilstedeværelsen af E coli i drikkevand, Fødevareforskere fra Cornell University kan nu bruge en bakteriofa
Virus skelner, ødelægge E. coli i drikkevandEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH For hurtigt at opdage tilstedeværelsen af E coli i drikkevand, Fødevareforskere fra Cornell University kan nu bruge en bakteriofa -
 Brug af bakterier til at fremskynde CO2-opsamling i haveneBerkeley Lab-forsker Peter Agbo blev tildelt en bevilling til et kulstoffangstprojekt under Labs Carbon Negative Initiative. Kredit:Marilyn Sargent/Berkeley Lab Du er måske bekendt med direkte luft
Brug af bakterier til at fremskynde CO2-opsamling i haveneBerkeley Lab-forsker Peter Agbo blev tildelt en bevilling til et kulstoffangstprojekt under Labs Carbon Negative Initiative. Kredit:Marilyn Sargent/Berkeley Lab Du er måske bekendt med direkte luft
- Hvem er den første person, der måler parallax af en stjerne?
- Fraunhofer -linjer i solspektret er faktisk?
- Fra sovesal til dominans:Voksesmerter, da Facebook fylder 15 år
- Kønsstereotyper gælder stadig for unge og typer af politisk deltagelse
- Hvorfor tapdanser farvning af giftfrøer?
- WISE J0720−0846 er vært for en massiv T-dværg, observationer bekræfter


