Hvilken type reaktion er kaliumpermangante?
Her er hvorfor:
* struktur: Kaliumpermanganat indeholder mangan i dens +7 oxidationstilstand, hvilket gør det meget elektronegativt. Dette betyder, at det let accepterer elektroner fra andre stoffer, hvilket får dem til at blive oxideret.
* redoxreaktioner: Permanganationen (MNO₄⁻) er ansvarlig for oxidationseffekten. I reaktioner reduceres det, normalt til mangandioxid (Mno₂), mangan (II) -ioner (Mn²⁺) eller manganat (VI) -ioner (Mno₄²⁻), afhængigt af reaktionsbetingelserne.
Eksempler på reaktioner:
* Oxidation af alkener: Kmno₄ kan spalte carbon-carbon-dobbeltbindinger i alkener og danne dioler (forbindelser med to hydroxylgrupper).
* Oxidation af alkoholer: Kmno₄ kan oxidere primære alkoholer til aldehyder eller carboxylsyrer og sekundære alkoholer til ketoner.
* Oxidation af aldehyder: Kmno₄ kan oxidere aldehyder til carboxylsyrer.
* Oxidation af sulfider: KMNO₄ kan oxidere sulfider til sulfoxider eller sulfoner.
Derfor, selvom ikke en reaktion i sig selv, er kaliumpermanganat en kraftig oxidator, der kan være involveret i forskellige redoxreaktioner.
 Varme artikler
Varme artikler
-
 Undersøgelse fremhæver lovende galliumoxider for næste generation af strålingsdetektorerKredit:CC0 Public Domain Ny forskning fra North Carolina State University viser, at strålingsdetektorer, der gør brug af enkeltkrystal galliumoxid, gør det muligt at overvåge røntgenstråling i næs
Undersøgelse fremhæver lovende galliumoxider for næste generation af strålingsdetektorerKredit:CC0 Public Domain Ny forskning fra North Carolina State University viser, at strålingsdetektorer, der gør brug af enkeltkrystal galliumoxid, gør det muligt at overvåge røntgenstråling i næs -
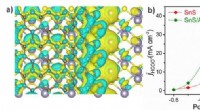 Forskere foreslår en ny strategi for elektrokemisk reduktion af kuldioxidDifferentialladningsdiagrammet for SnS/Aminated-C for (a) og den delvise strømtæthed af formiatproduktion for SnS og SnS/Aminated-C for (b). Kredit:CHEN Zhipeng Kuldioxid (CO 2 ) emission er ble
Forskere foreslår en ny strategi for elektrokemisk reduktion af kuldioxidDifferentialladningsdiagrammet for SnS/Aminated-C for (a) og den delvise strømtæthed af formiatproduktion for SnS og SnS/Aminated-C for (b). Kredit:CHEN Zhipeng Kuldioxid (CO 2 ) emission er ble -
 Modulerende foto- og elektroluminescens i et stimuli-responsivt molekylært farvestofKredit:Wiley Kontrol af de exciterede elektroniske tilstande i selvlysende systemer er fortsat en udfordring i udviklingen af fluorescerende og phosphorescerende farvestoffer. Nu, videnskabsmænd
Modulerende foto- og elektroluminescens i et stimuli-responsivt molekylært farvestofKredit:Wiley Kontrol af de exciterede elektroniske tilstande i selvlysende systemer er fortsat en udfordring i udviklingen af fluorescerende og phosphorescerende farvestoffer. Nu, videnskabsmænd -
 En ikke-destruktiv metode til at analysere oldægyptiske balsameringsmaterialerForskere analyserede balsameringsmateriale fra halsen på denne gamle egyptiske mumie, som blev erhvervet af et fransk museum i 1837. Kredit:Frédérique Vincent, etnografisk konservator Gamle egypti
En ikke-destruktiv metode til at analysere oldægyptiske balsameringsmaterialerForskere analyserede balsameringsmateriale fra halsen på denne gamle egyptiske mumie, som blev erhvervet af et fransk museum i 1837. Kredit:Frédérique Vincent, etnografisk konservator Gamle egypti
- Hvad er den medicinske betegnelse, der betyder betingelse forårsaget af mangelfulde gener?
- Sådan beregnes en vinkel med Trig
- Rapport skitserer voksende klimaændringsrelaterede trusler mod Great Lakes-regionen
- Hvad betyder det, når stjerner er i kø?
- Hvor mange galakser er synlige for det blotte øje?
- Er moralen placeret i hjernen?


