Forklar hvorfor benzen C6H6 har et lavere kogepunkt end vand?
* Intermolekylære kræfter: Styrken af intermolekylære kræfter (IMF'er) mellem molekyler påvirker direkte kogepunktet. Stærkere IMF'er kræver mere energi for at overvinde, hvilket resulterer i højere kogepunkter.
* Vand: Vandmolekyler danner stærke brintbindinger. Disse bindinger er den stærkeste type dipol-dipol-interaktion, hvilket kræver betydelig energi til at bryde.
* benzen: Benzen er et ikke -polært molekyle, hvilket betyder, at det ikke har noget permanent dipolmoment. Dens primære IMF'er er svage London -spredningskræfter, der opstår som følge af midlertidige udsving i elektronfordeling.
* molekylvægt: Mens benzen har en højere molekylvægt end vand, forklarer denne faktor alene ikke det lavere kogepunkt. Stærkere IMF'er opvejer typisk virkningerne af molekylvægt.
Kortfattet: Vands stærke brintbindinger er langt mere markante til at holde sine molekyler sammen end de svage London -spredningskræfter i benzen. Denne forskel i intermolekylære kræfter forklarer den betydelige forskel i kogepunkter.
Sidste artikelHvad er den korrekte formel og ladning for en ion af nitrat?
Næste artikelHvilken type reaktion er kaliumpermangante?
 Varme artikler
Varme artikler
-
 Ny genanvendelig hydrogel kunne høste rent, afsaltet vand fra fugtig luft over havoverfladerDen nye hydrogel udviklet af et team fra National University of Singapore, ledet af adjunkt Tan Swee Ching (yderst til højre), kan bruges til at høste rent vand fra fugtig luft over havoverflader, blo
Ny genanvendelig hydrogel kunne høste rent, afsaltet vand fra fugtig luft over havoverfladerDen nye hydrogel udviklet af et team fra National University of Singapore, ledet af adjunkt Tan Swee Ching (yderst til højre), kan bruges til at høste rent vand fra fugtig luft over havoverflader, blo -
 Team løser et årti gammelt mysterium i kemiske transformationerPariserhjulet viser den katalytiske carboxylcyklus. Kredit:Cortland Johnson Forskere ved Pacific Northwest National Laboratory (PNNL) har løst et mysterium for en kemisk reaktion, der er afgørende
Team løser et årti gammelt mysterium i kemiske transformationerPariserhjulet viser den katalytiske carboxylcyklus. Kredit:Cortland Johnson Forskere ved Pacific Northwest National Laboratory (PNNL) har løst et mysterium for en kemisk reaktion, der er afgørende -
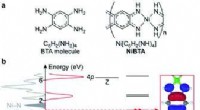 Forskere afdækker arbejdsprincipperne for et lovende materiale til hurtigopladning af batterier(a) Formler for BTA-molekyle og NiBTA og (b) elektronisk struktur af NiBTA. Den elektroniske struktur er opdelt i σ- og π-systemer. π-systemet dekomponeres yderligere i LMOer af Ni- og BTA-blokke. Tæt
Forskere afdækker arbejdsprincipperne for et lovende materiale til hurtigopladning af batterier(a) Formler for BTA-molekyle og NiBTA og (b) elektronisk struktur af NiBTA. Den elektroniske struktur er opdelt i σ- og π-systemer. π-systemet dekomponeres yderligere i LMOer af Ni- og BTA-blokke. Tæt -
 Gør hundefoder mere lækker ved at analysere aromaerKredit:CC0 Public Domain Hunde er ikke kendt for at være kræsne omkring deres mad, spiser den samme kibble dag efter dag med nydelse. Imidlertid, ejere af forkælede pooches vil have, at deres kæle
Gør hundefoder mere lækker ved at analysere aromaerKredit:CC0 Public Domain Hunde er ikke kendt for at være kræsne omkring deres mad, spiser den samme kibble dag efter dag med nydelse. Imidlertid, ejere af forkælede pooches vil have, at deres kæle
- Hvorfor forekommer tidevand på vores planet?
- UA del af gruppen, der er ved at optrevle, hvordan hjernen styrer hukommelsen
- Proxima Centauri har lige udgivet en opblussen så kraftig, at den var synlig for det blotte øje
- Hvilke materialer og hvor meget energi bruges til at fremstille blæk?
- Hvordan man laver en detaljeret menneskelig hjerne model ud af Clay
- Hvordan tillader nuklearkonvolutten celleproduktion?


