Hvad er antallet af atomer, der er til stede i et 20 gram prøve lithium?
1. Find den molære masse af lithium:
* Den molære masse af lithium (Li) er ca. 6,941 g/mol.
2. Beregn antallet af mol:
* Opdel massen af prøven med den molære masse:
* Mol Li =(20 g) / (6,941 g / mol) ≈ 2,88 mol
3. Brug Avogadros nummer:
* Avogadros nummer fortæller os, at der er 6,022 x 10^23 atomer i en mol af ethvert stof.
* Multiplicer antallet af mol med Avogadros nummer:
* Antal atomer =(2,88 mol) * (6,022 x 10^23 atomer/mol) ≈ 1,73 x 10^24 atomer
Derfor er der cirka 1,73 x 10^24 atomer til stede i en 20 gram prøve af lithium.
Sidste artikelHvad er nogle vigtige anvendelser af svovl?
Næste artikelHvor mange atomer er der i 34 gram lithium?
 Varme artikler
Varme artikler
-
 Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o
Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o -
 Styring af kemiske reaktioner nær det absolutte nulKredit:CC0 Public Domain Det er en underdrivelse at sige, at kemiske reaktioner finder sted overalt, konstant. Både i naturen og i laboratoriet, kemi er allestedsnærværende. Men på trods af fremsk
Styring af kemiske reaktioner nær det absolutte nulKredit:CC0 Public Domain Det er en underdrivelse at sige, at kemiske reaktioner finder sted overalt, konstant. Både i naturen og i laboratoriet, kemi er allestedsnærværende. Men på trods af fremsk -
 Forskning finder et godt sted til at udvikle bedre cellulosenedbrydende enzymerPostdoc-forsker Antonella Amore og senioringeniør Brandon Knott arbejder på prøver i laboratoriet. Den nye forskning om forholdet mellem små sukkerarter (glykaner), deres funktion, og deres placering
Forskning finder et godt sted til at udvikle bedre cellulosenedbrydende enzymerPostdoc-forsker Antonella Amore og senioringeniør Brandon Knott arbejder på prøver i laboratoriet. Den nye forskning om forholdet mellem små sukkerarter (glykaner), deres funktion, og deres placering -
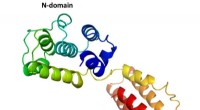 Forskere spoler i strukturen af laksevirusDen første komplette struktur af et M1-protein fra en infektiøs lakseanæmivirus, som afsløret af forskere ved Rice University. Strukturen af proteinet, som danner et beskyttende skjold omkring det v
Forskere spoler i strukturen af laksevirusDen første komplette struktur af et M1-protein fra en infektiøs lakseanæmivirus, som afsløret af forskere ved Rice University. Strukturen af proteinet, som danner et beskyttende skjold omkring det v


