Hvordan binder du kovalent aluminium og svovl?
Udfordringer:
* Elektronegativitet: Aluminium (AL) er et metal med relativt lav elektronegativitet, mens svovl (er) er en ikke -metal med høj elektronegativitet. Denne forskel gør dem mere tilbøjelige til at danne ioniske bindinger, hvor elektroner overføres, snarere end kovalente bindinger, hvor elektroner deles.
* aluminiums præference: Aluminium foretrækker typisk at danne ioniske bindinger med ikke -metaller.
hvordan de binder:
* Høje temperaturer: Kovalent binding mellem aluminium og svovl kan forekomme ved meget høje temperaturer (over 1000 ° C). Under disse ekstreme forhold er det mere sandsynligt, at aluminiumatomerne deler elektroner med svovlatomer.
* specifikke betingelser: Aluminiumsulfid (Al₂s₃) kan dannes som en fast forbindelse under de rigtige betingelser. Imidlertid er det ofte ustabilt og har en tendens til at nedbrydes tilbage i dets elementer.
Resultatet:
Den kovalente binding mellem aluminium og svovl i al₂s₃ betragtes som polær kovalent . Dette betyder, at de delte elektroner ikke deles lige så, og svovlatomet vil have en lidt negativ ladning, mens aluminiumatomet vil have en lidt positiv ladning.
Vigtig note:
* Dannelsen af kovalente bindinger mellem aluminium og svovl er en kompleks proces, der kræver specifikke betingelser.
* I de fleste tilfælde fører interaktionen mellem aluminium og svovl til dannelsen af ioniske forbindelser.
Fortæl mig, hvis du gerne vil vide mere om specifikke reaktionsbetingelser eller egenskaber ved aluminiumssulfid!
Sidste artikelHvad er den kemiske formel for kulstofchlorid?
Næste artikelHvor mange gram natriumchlorid er i 0,40 mol?
 Varme artikler
Varme artikler
-
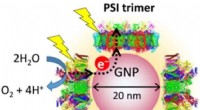 Ny nanodeenhed kan bruge solenergi til at producere brintSkematisk visning af et PSI-GNP-PSII-konjugat designet i denne undersøgelse. Elektronacceptor og donorsider af PSII- og PSI -komplekser, henholdsvis, er knyttet til en BNP gennem (His) 6 tags og Ni-ni
Ny nanodeenhed kan bruge solenergi til at producere brintSkematisk visning af et PSI-GNP-PSII-konjugat designet i denne undersøgelse. Elektronacceptor og donorsider af PSII- og PSI -komplekser, henholdsvis, er knyttet til en BNP gennem (His) 6 tags og Ni-ni -
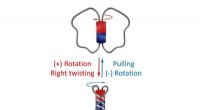 Alle afviklede:En reversibel molekylær hvirvelDenne molekylære hvirvel kan vrides reversibelt, og forskere kan måle dens kræfter. Kredit:Tilpasset fra Journal of the American Chemical Society (2022), DOI:10.1021/jacs.2c02547 I løbet af de sids
Alle afviklede:En reversibel molekylær hvirvelDenne molekylære hvirvel kan vrides reversibelt, og forskere kan måle dens kræfter. Kredit:Tilpasset fra Journal of the American Chemical Society (2022), DOI:10.1021/jacs.2c02547 I løbet af de sids -
 Forskere gør plastforurening til rengøringsmidlerKredit:CC0 Public Domain Forskere ved University of Bristol har opdaget en måde at genbruge en almindelig plast til at nedbryde skadelige farvestoffer i vores spildevand. Papiret offentliggjort i
Forskere gør plastforurening til rengøringsmidlerKredit:CC0 Public Domain Forskere ved University of Bristol har opdaget en måde at genbruge en almindelig plast til at nedbryde skadelige farvestoffer i vores spildevand. Papiret offentliggjort i -
 Danner den ion, der skabte universettrihydrogenkationen, H 3+ , spiller en stor rolle i interstellar kemi, hvor det letter dannelsen af vand og organiske molekyler. Forskere har opdaget, hvordan kationen dannes, når organiske moleky
Danner den ion, der skabte universettrihydrogenkationen, H 3+ , spiller en stor rolle i interstellar kemi, hvor det letter dannelsen af vand og organiske molekyler. Forskere har opdaget, hvordan kationen dannes, når organiske moleky
- Rumvejr er svært at forudsige - med kun en time til at forhindre katastrofer på Jorden
- Hvad hvis du var på en elevator, og kablet gik i stykker?
- Hvor mange atomer er der i 3,5 mol kulstof?
- Hvordan er encellede organismer bedre end flercellede organismer?
- Hvordan studerede folk stjerner for 200 år siden?
- Hvorfor betjener du apliance, når hånden er våd?


