Hvordan ændres arrangementet af elektroner, når natrium reagerer med klor for at danne chlorid?
natrium (NA)
* starttilstand: Natrium har 1 elektron i sin yderste skal (Valence Shell). Det har den elektroniske konfiguration 2, 8, 1.
* Ønske: Natrium ønsker at miste denne enkelt valenselektron for at opnå en stabil oktet (8 elektroner) i sin yderste skal, ligesom de ædle gasser.
klor (Cl)
* starttilstand: Klor har 7 elektroner i sin yderste skal. Dens elektroniske konfiguration er 2, 8, 7.
* Ønske: Klor ønsker at få et elektron for at afslutte sin oktet og blive stabil.
reaktionen:
1. Elektronoverførsel: Når natrium og klor reagerer, opgiver Natrium let sin enkle valenselektron til klor.
2. iondannelse: Natrium, efter at have mistet et elektron, bliver en positivt ladet ion (Na⁺). Klor, efter at have fået en elektron, bliver en negativt ladet ion (CL⁻).
3. ionisk binding: De modsatte ladede ioner er stærkt tiltrukket af hinanden og danner en ionisk binding. Dette skaber forbindelsen natriumchlorid (NaCl).
Endelig tilstand:
* natrium (Na⁺): Har nu den elektroniske konfiguration 2, 8. Det har en komplet oktet og en positiv ladning.
* klor (cl⁻): Har nu den elektroniske konfiguration 2, 8, 8. Den har en komplet oktet og en negativ ladning.
Nøglepunkter:
* Reaktionen er drevet af begge atomeres ønske om at opnå en stabil oktetkonfiguration.
* Denne elektronoverførsel resulterer i dannelsen af ioner med modsatte afgifter.
* Den stærke elektrostatiske attraktion mellem disse ioner skaber den ioniske binding, der holder natriumchloridforbindelsen sammen.
Sidste artikelJern III nitrat og natriumthiocyanat?
Næste artikelNår natrium mister en elektron, og klor får en, hvilken interaktion dannes?
 Varme artikler
Varme artikler
-
 Forskere arbejder sammen med små virksomheder i NM for at teste nye respiratormaterialerSandia National Laboratories hovedefterforsker Michael Omana indsætter en opløsning i et lille kammer, der bruges til at øge fugtigheden på prøverne. Omana og et team af forskere testede materialer fo
Forskere arbejder sammen med små virksomheder i NM for at teste nye respiratormaterialerSandia National Laboratories hovedefterforsker Michael Omana indsætter en opløsning i et lille kammer, der bruges til at øge fugtigheden på prøverne. Omana og et team af forskere testede materialer fo -
 Nye stoffer med antivirale egenskaberKredit:CC0 Public Domain Brasilianske tekstilvirksomheder er begyndt at producere og markedsføre stoffer behandlet med sølv- og silica -nanopartikler udviklet af forskningsgrupperne ved Center for
Nye stoffer med antivirale egenskaberKredit:CC0 Public Domain Brasilianske tekstilvirksomheder er begyndt at producere og markedsføre stoffer behandlet med sølv- og silica -nanopartikler udviklet af forskningsgrupperne ved Center for -
 Grafitbelægning gør perovskit-solceller vandtætteForskere brugte grafitfilm til at belægge perovskit-solceller og vandtætte dem. Kredit:Isabella Poli En billigere, en renere og mere bæredygtig måde at fremstille brintbrændstof fra vand ved hjælp
Grafitbelægning gør perovskit-solceller vandtætteForskere brugte grafitfilm til at belægge perovskit-solceller og vandtætte dem. Kredit:Isabella Poli En billigere, en renere og mere bæredygtig måde at fremstille brintbrændstof fra vand ved hjælp -
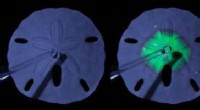 Fra søpindsvinskelet til solcellerDenne billedserie viser et skelet med sanddollar, der gradvist konverterer til en lysemitterende perovskit. Snapshots af denne konvertering er taget på 0s, 5s, 15erne, og 40erne. Kredit:Noorduin Lab,
Fra søpindsvinskelet til solcellerDenne billedserie viser et skelet med sanddollar, der gradvist konverterer til en lysemitterende perovskit. Snapshots af denne konvertering er taget på 0s, 5s, 15erne, og 40erne. Kredit:Noorduin Lab,
- Hvilke politikere giver vælgerne skylden for den dårlige økonomi?
- Bio møder nano:Kvanteprikker som lysantenner til kunstige fotosyntetiske systemer
- G20:Gå på kompromis med klimaændringer, men til hvilken pris?
- Tumorer oplyste klart og præcist med ny biologisk nedbrydelig nanoprobe
- Nye Ceres ser, da Dawn rykker højere
- Vægtløftere og dykkere tilbyder en lektion for virksomheder i risiko og belønning


