Hvad er der involveret i en kemisk reaktion?
1. Reaktanter:
* Dette er udgangsmaterialerne i en kemisk reaktion.
* Det er de stoffer, der gennemgår en kemisk ændring.
* De har specifikke kemiske formler og egenskaber.
2. Produkter:
* Dette er de stoffer, der er dannet som et resultat af den kemiske reaktion.
* De har forskellige kemiske formler og egenskaber end reaktanterne.
3. Kemiske bindinger:
* Kemiske reaktioner involverer brud og dannelse af kemiske bindinger mellem atomer.
* Bindinger holder atomer sammen i molekyler.
* Fremskridt og dannelse af obligationer involverer energiændringer.
4. Energiændringer:
* Kemiske reaktioner kan frigive eller absorbere energi.
* eksotermiske reaktioner Slip energi, ofte i form af varme eller lys.
* endotermiske reaktioner absorbere energi fra deres omgivelser.
5. Reaktionsbetingelser:
* Kemiske reaktioner kræver ofte specifikke betingelser for at forekomme, såsom:
* Temperatur: Højere temperaturer fremskynder ofte reaktioner.
* tryk: Ændringer i tryk kan påvirke hastigheden af gasfasereaktioner.
* Koncentration: Mængden af reaktanter kan påvirke reaktionshastigheden.
* katalysator: En katalysator fremskynder en reaktion uden at blive fortæret selv.
6. Reaktionsmekanismer:
* Dette er den trin-for-trin-sekvens af begivenheder, der forekommer under en reaktion.
* Den beskriver mellemprodukter og overgangstilstande, der er involveret i processen.
7. Kemiske ligninger:
* Kemiske reaktioner er repræsenteret ved hjælp af kemiske ligninger.
* Disse ligninger viser reaktanterne på venstre side og produkterne på højre side med pile, der angiver reaktionens retning.
* Koefficienter foran de kemiske formler angiver antallet af mol af hvert involveret stof.
Nøglekoncepter:
* bevarelse af masse: I en kemisk reaktion skal reaktanternes samlede masse svarer til den samlede masse af produkterne.
* Energibesparelse: Energi kan ikke oprettes eller ødelægges, kun transformeres fra en form til en anden.
* ligevægt: Mange kemiske reaktioner er reversible, hvilket betyder, at de kan fortsætte i både fremad- og omvendt retninger. Ligevægt nås, når hastighederne for de fremadrettede og omvendte reaktioner er ens.
Eksempler på kemiske reaktioner:
* forbrænding: Brændende brændstof, såsom træ eller propan, frigiver varme og lys.
* Fotosyntese: Planter bruger sollys, kuldioxid og vand til at producere glukose og ilt.
* Rusting: Jern reagerer med ilt og vand for at danne jernoxid (rust).
At forstå de koncepter, der er involveret i kemiske reaktioner, er grundlæggende for kemi og spiller en afgørende rolle inden for forskellige områder, herunder medicin, landbrug og materialevidenskab.
 Varme artikler
Varme artikler
-
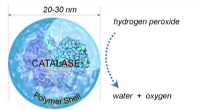 Fælles antioxidantenzym kan give potentiel behandling for COVID-19Simpelt diagram, der viser katalase kickstartreaktion, der omdanner hydrogenperoxid til vand og oxygen. Kredit:Yunfeng Lu forskningsgruppe/UCLA Forskere fra UCLA og Kina har fundet ud af, at katal
Fælles antioxidantenzym kan give potentiel behandling for COVID-19Simpelt diagram, der viser katalase kickstartreaktion, der omdanner hydrogenperoxid til vand og oxygen. Kredit:Yunfeng Lu forskningsgruppe/UCLA Forskere fra UCLA og Kina har fundet ud af, at katal -
 Tube orm slim viser langtidsholdbar, selvdrevet glødFotografiet til venstre viser den marine pergamentrørorm (Chaetopterus sp.) under naturligt lys. Ormen er krøllet sammen, stikker halen under hovedet. Billedet til højre viser den samme orm, men i mør
Tube orm slim viser langtidsholdbar, selvdrevet glødFotografiet til venstre viser den marine pergamentrørorm (Chaetopterus sp.) under naturligt lys. Ormen er krøllet sammen, stikker halen under hovedet. Billedet til højre viser den samme orm, men i mør -
 Opbygning af en bedre biosensorpolymerFlere kritiske udfordringer blev overvundet for at udvikle den nye type polymer, der har et stort potentiale for næste generations biosensorer. Kredit:KAUST; Xavier Pita Der er udviklet et nyt org
Opbygning af en bedre biosensorpolymerFlere kritiske udfordringer blev overvundet for at udvikle den nye type polymer, der har et stort potentiale for næste generations biosensorer. Kredit:KAUST; Xavier Pita Der er udviklet et nyt org -
 Retsmedicinsk kemiker foreslår svedteststrimmel som erstatning for alkometerUniversitetet i Albany retsmedicinsk kemiker Jan Halámek. Kredit:Paul Miller Retsmedicineren Jan Halámek har igen fundet en innovativ anvendelse til menneskelig sved - denne gang for at holde fuld
Retsmedicinsk kemiker foreslår svedteststrimmel som erstatning for alkometerUniversitetet i Albany retsmedicinsk kemiker Jan Halámek. Kredit:Paul Miller Retsmedicineren Jan Halámek har igen fundet en innovativ anvendelse til menneskelig sved - denne gang for at holde fuld
- Hvorfor blev universal indikatorpapir brugt til at teste pH -værdien i stedet for at placere opløs…
- Hvordan måling af emissioner i realtid kan hjælpe byer med at opnå netto nul
- Hvilken dato jord er i korteste afstand fra solen?
- Næste generations opløsningsmidler fanger kulstof med halvdelen af energien
- Hvad gør af majoritetens kropsvægt til et menneske?
- Spiselige vilde svampe i Illinois


