Når kalium- og bromatomer danner kemiske bindinger, hvad produceres der?
Her er hvorfor:
* kalium (k) er et metal i gruppe 1 i den periodiske tabel. Det har en valenselektron, som den let mister for at opnå en stabil elektronkonfiguration.
* brom (Br) er en ikke -metal i gruppe 17. Det har syv valenselektroner og har brug for en mere for at opnå en stabil elektronkonfiguration.
Når kalium og brom reagerer, mister kalium sin valenselektron og danner en positivt ladet kaliumion (K+). Brom vinder denne elektron og danner en negativt ladet bromidion (BR-). Disse modsatte ladede ioner tiltrækker hinanden elektrostatisk og danner en ionisk binding. Denne ioniske binding resulterer i dannelsen af kaliumbromid (KBR), et hvidt krystallinsk fast stof.
 Varme artikler
Varme artikler
-
 Medicinske kemiske gennembrud kan føre til bedre lægemidlerKemiprofessor W. Dean Harman ledede et team, der udviklede en ny metode til fremstilling af lægemidler. Kredit:Dan Addison, Universitetets kommunikation Medicin er udviklet til at fungere godt for
Medicinske kemiske gennembrud kan føre til bedre lægemidlerKemiprofessor W. Dean Harman ledede et team, der udviklede en ny metode til fremstilling af lægemidler. Kredit:Dan Addison, Universitetets kommunikation Medicin er udviklet til at fungere godt for -
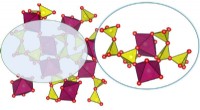 En overlegen, lavpris katalysator til vandspaltningStruktur af NaCo (PO3) 3metaphosphat med et udvidet billede af hjørnedelings [CoO6] octahedra og [PO4] tetraeder byggesten. Kredit:Indian Institute of Science I et væsentligt skridt mod storstilet
En overlegen, lavpris katalysator til vandspaltningStruktur af NaCo (PO3) 3metaphosphat med et udvidet billede af hjørnedelings [CoO6] octahedra og [PO4] tetraeder byggesten. Kredit:Indian Institute of Science I et væsentligt skridt mod storstilet -
 3-D-printet enhed finder nål i en høstak cancerceller ved at fjerne høetEn 3D-printet cellefælde udviklet i laboratoriet hos Georgia Tech Assistant Professor A. Fatih Sarioglu fanger blodceller for at isolere tumorceller fra en blodprøve. Kredit:Allison Carter, Georgia Te
3-D-printet enhed finder nål i en høstak cancerceller ved at fjerne høetEn 3D-printet cellefælde udviklet i laboratoriet hos Georgia Tech Assistant Professor A. Fatih Sarioglu fanger blodceller for at isolere tumorceller fra en blodprøve. Kredit:Allison Carter, Georgia Te -
 Ny metode til fortolkning af cryo-EM-kort gør det lettere at bestemme proteinstrukturerDaisuke Kihara og Genki Terashi har skabt en ny metode til fortolkning af densitetskort bestemt med kryo-elektronmikroskopi. Kredit:Purdue University foto/John Underwood En ny algoritme gør fortol
Ny metode til fortolkning af cryo-EM-kort gør det lettere at bestemme proteinstrukturerDaisuke Kihara og Genki Terashi har skabt en ny metode til fortolkning af densitetskort bestemt med kryo-elektronmikroskopi. Kredit:Purdue University foto/John Underwood En ny algoritme gør fortol
- En temperatur på 200 F svarer til cirka hvad Celsius?
- Forskere afbilder perfekt glatte sideoverflader af 3-D siliciumkrystaller med et scanningstunnelmikr…
- Vis mig dit DNA og jeg fortæller dig øjenfarve
- Forskere skal lære robotter at skelne mellem sandwich-ingredienser
- Ny sandwichteknologi forbedrer følsomheden af hurtige tests
- Politiseret pandemi formet overholdelse af social distancering


