Hvorfor findes nitrogenpentafluorid ikke?
Her er en sammenbrud:
* nitrogens elektroniske konfiguration: Nitrogen har 5 valenselektroner. For at danne fem obligationer skal det udvide sin oktet til at rumme 10 elektroner. Nitrogen udvider imidlertid ikke let sin oktet ud over otte elektroner. Dette skyldes, at 2p -orbitaler er de eneste, der er tilgængelige til limning, og de kan kun holde maksimalt otte elektroner.
* sterisk hindring: Selv hvis nitrogen kunne udvide sin oktet, ville de fem fluoratomer være ekstremt overfyldte omkring nitrogenatomet. Denne alvorlige steriske hindring ville gøre molekylet meget ustabil og sandsynligvis nedbrydes.
alternative forbindelser:
Mens NF5 ikke er stabil, findes andre nitrogenfluorider, som nitrogentrifluorid (NF3), som er en stabil forbindelse.
Kortfattet: Nitrogenpentafluorid er ikke en levedygtig forbindelse på grund af begrænsninger i nitrogens elektroniske konfiguration og signifikant sterisk hindring.
Sidste artikelHvorfor sodavand er en blanding og vandforbindelse?
Næste artikelEr ammoniumion polær ikke eller ionisk?
 Varme artikler
Varme artikler
-
 Hvad kan muslingeskaller lære os om den cirkulære økonomi?Kredit:Edwin van Tongeren I en cirkulær økonomi, design handler om mere end blot at skabe et bæredygtigt produkt. I dette system baseret på at eliminere spild og minimere brugen af ressourcer, D
Hvad kan muslingeskaller lære os om den cirkulære økonomi?Kredit:Edwin van Tongeren I en cirkulær økonomi, design handler om mere end blot at skabe et bæredygtigt produkt. I dette system baseret på at eliminere spild og minimere brugen af ressourcer, D -
 To-faset materiale med overraskende egenskaberMikroskopiske polymerstrukturer. Kredit:Vienna University of Technology Mikrostruktur og makroskopiske elektro-mekaniske egenskaber er tæt forbundet i såkaldte ferroelektriske polymerer. Der er nu
To-faset materiale med overraskende egenskaberMikroskopiske polymerstrukturer. Kredit:Vienna University of Technology Mikrostruktur og makroskopiske elektro-mekaniske egenskaber er tæt forbundet i såkaldte ferroelektriske polymerer. Der er nu -
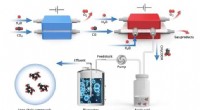 Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen
Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen -
 Ny NMR-teknik tilbyder molekylært vindue til levende organismerProfessor Andre Simpson har udviklet en ny NMR-teknik, der kan få en højopløselig profil af, hvilke molekyler der er til stede inde i en levende organisme. Kredit:Ken Jones En ny teknik udviklet a
Ny NMR-teknik tilbyder molekylært vindue til levende organismerProfessor Andre Simpson har udviklet en ny NMR-teknik, der kan få en højopløselig profil af, hvilke molekyler der er til stede inde i en levende organisme. Kredit:Ken Jones En ny teknik udviklet a


