Hvorfor er vand (H2O) en væske ved stuetemperatur, hvorimod ammoniak (NH3) gastemperatur?
Her er en sammenbrud:
vand (H₂O):
* stærkere intermolekylære kræfter: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (brint) og en lidt negativ ende (ilt). Dette giver dem mulighed for at danne stærke brintbindinger med hinanden.
* Hydrogenbinding: Hydrogenbindinger er en type stærk dipol-dipolinteraktion, hvor et hydrogenatom bundet til et stærkt elektronegativt atom (som ilt) danner et binding med et elektronegativt atom i et nærliggende molekyle.
* Højt kogepunkt: De stærke hydrogenbindinger kræver en masse energi for at bryde, hvilket fører til et relativt højt kogepunkt på 100 ° C.
ammoniak (NH₃):
* svagere intermolekylære kræfter: Mens ammoniak også er et polært molekyle, danner det svagere brintbindinger end vand. Dette skyldes, at nitrogenatomet er mindre elektronegativt end ilt, hvilket fører til svagere attraktioner mellem molekyler.
* lavere kogepunkt: De svagere intermolekylære kræfter kræver mindre energi for at bryde, hvilket resulterer i et meget lavere kogepunkt på -33,34 ° C.
stuetemperatur:
Da stuetemperatur typisk er omkring 20-25 ° C, holder vandets stærke brintbindinger det i en flydende tilstand. På den anden side tillader ammoniaks svagere intermolekylære kræfter det at eksistere som en gas ved stuetemperatur.
Kortfattet: Water's stærke brintbindinger er ansvarlige for dets flydende tilstand ved stuetemperatur, mens ammoniaks svagere brintbindinger fører til dens gasformige tilstand.
Sidste artikelHvilke salte og natriumhydroxid producerer ammoniakgas?
Næste artikelHvorfor opsamles ammoniakgas i en omvendt krukke?
 Varme artikler
Varme artikler
-
 Fra hårdt til blødt:Fremstilling af svampe af muslingeskallerBlåmuslingeskaller efter indledende behandling med eddikesyre. Kredit:Jennifer Murphy Forskere har opdaget en svampet form for calciumcarbonat (CaCO 3 ), et materiale fundet i kalksten, kridt, m
Fra hårdt til blødt:Fremstilling af svampe af muslingeskallerBlåmuslingeskaller efter indledende behandling med eddikesyre. Kredit:Jennifer Murphy Forskere har opdaget en svampet form for calciumcarbonat (CaCO 3 ), et materiale fundet i kalksten, kridt, m -
 Forstå hvordan monomersekvens påvirker konduktans i molekylære ledningerForskere i Schroeder- og Moore-grupperne ved University of Illinois er interesserede i at bygge og studere kædemolekyler med høje præcisionsniveauer. På billedet fra venstre, Hao Yu, kandidatstuderend
Forstå hvordan monomersekvens påvirker konduktans i molekylære ledningerForskere i Schroeder- og Moore-grupperne ved University of Illinois er interesserede i at bygge og studere kædemolekyler med høje præcisionsniveauer. På billedet fra venstre, Hao Yu, kandidatstuderend -
 Omdannelse af spildevandsbiprodukter til bæredygtige grønne brændstofferKredit:Jonutis, Shutterstock En enorm mængde organisk affald fra forskellige sektorer ender enten på lossepladser eller bliver forbrændt, yderligere stigende drivhusgasemissioner (GHG) og jord- og
Omdannelse af spildevandsbiprodukter til bæredygtige grønne brændstofferKredit:Jonutis, Shutterstock En enorm mængde organisk affald fra forskellige sektorer ender enten på lossepladser eller bliver forbrændt, yderligere stigende drivhusgasemissioner (GHG) og jord- og -
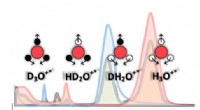 Flydende vand er mere end bare brint-ilt-molekylerInfrarøde lysspektre (rødt), tung (blå), halvtungt (grå) vand, og ioniske arter, der er blevet identificeret i den aktuelle undersøgelse. Rød, hvide og sorte cirkler viser ilt, hydrogen- og deuteriuma
Flydende vand er mere end bare brint-ilt-molekylerInfrarøde lysspektre (rødt), tung (blå), halvtungt (grå) vand, og ioniske arter, der er blevet identificeret i den aktuelle undersøgelse. Rød, hvide og sorte cirkler viser ilt, hydrogen- og deuteriuma
- En ny måde at producere rent brintbrændstof fra vand ved hjælp af sollys
- Hvad er jordens omstændighed i miles?
- Hvad er videnskabelig metode i renæssance?
- Silicium nanoblok arrays skaber levende farver med subbølgelængde opløsning
- Er metaboliserende fedt en del af kemisk ændring?
- Orkanen Elsa truer Caribien


