Hvordan adskiller iltgas sig fra fluor- og klorgas?
1. Reaktivitet:
* ilt (O 2 ): Oxygen er et relativt reaktivt element, men ikke så reaktiv som fluor eller klor. Det understøtter forbrænding og er vigtig for respiration.
* fluor (f 2 ): Fluor er det mest reaktive ikke-metalliske element. Det reagerer let med de fleste elementer, inklusive ædelgasser, og kan endda oxidere ilt.
* klor (cl 2 ): Chlor er et meget reaktivt element, men mindre reaktiv end fluor. Det er et stærkt oxidationsmiddel og bruges som desinfektionsmiddel og blegemiddel.
2. Fysiske egenskaber:
* ilt (O 2 ): Farveløs, lugtfri og smagløs gas. Det er lidt tættere end luft.
* fluor (f 2 ): Bleg gul gas med en skarp, irriterende lugt. Det er meget giftigt.
* klor (cl 2 ): Gulgrøn gas med en skarp, kvælende lugt. Det er giftigt og kan forårsage åndedrætsirritation.
3. Kemisk binding:
* ilt (O 2 ): Oxygen danner dobbeltbindinger i dets diatomiske molekyle (O =O).
* fluor (f 2 ): Fluor danner en enkelt binding i dets diatomiske molekyle (F-F).
* klor (cl 2 ): Klor danner en enkelt binding i dets diatomiske molekyle (CL-CL).
4. Forekomst i naturen:
* ilt (O 2 ): Oxygen er det mest rigelige element i jordens skorpe og atmosfære.
* fluor (f 2 ): Fluor findes i mineraler såsom fluorit og kryolit.
* klor (cl 2 ): Klor findes i havvand og andre naturlige saltvand.
5. Anvendelser:
* ilt (O 2 ): Væsentlig for respiration, forbrænding og industrielle processer.
* fluor (f 2 ): Brugt til produktion af teflon, kølemidler og farmaceutiske stoffer.
* klor (cl 2 ): Brugt som desinfektionsmiddel, blegemiddel og i produktionen af plast og pesticider.
Kortfattet:
Reaktiviteten, fysiske egenskaber, kemisk binding, naturlig overflod og anvendelse af ilt-, fluor- og klorgasser adskiller sig markant på grund af deres forskellige elektroniske konfigurationer og atomstørrelser.
Sidste artikelHvor vinylchlorid og acetydehyd er keto -enol -tautomere?
Næste artikelHvad udgør et opløst stof og opløsningsmiddel?
 Varme artikler
Varme artikler
-
 Selvdrevne papirbaserede SPED'er kan føre til nye medicinsk-diagnostiske værktøjerNy papirbaseret diagnostisk enhed detekterer biomarkører og identificerer sygdomme ved at udføre elektrokemiske analyser, og analyserne skifter farve for at indikere specifikke testresultater. Enheden
Selvdrevne papirbaserede SPED'er kan føre til nye medicinsk-diagnostiske værktøjerNy papirbaseret diagnostisk enhed detekterer biomarkører og identificerer sygdomme ved at udføre elektrokemiske analyser, og analyserne skifter farve for at indikere specifikke testresultater. Enheden -
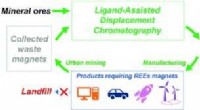 Teknologier til at udvinde, rense kritiske sjældne jordarters metaller kunne være en game changerKredit: Grøn Kemi (2020). DOI:10.1039/D0GC00495B Teknologien – udviklet og patenteret fra Nien-Hwa Linda Wangs laboratorium, Purdues Maxine Spencer Nichols professor i kemiteknik – har med succes
Teknologier til at udvinde, rense kritiske sjældne jordarters metaller kunne være en game changerKredit: Grøn Kemi (2020). DOI:10.1039/D0GC00495B Teknologien – udviklet og patenteret fra Nien-Hwa Linda Wangs laboratorium, Purdues Maxine Spencer Nichols professor i kemiteknik – har med succes -
 Ny svampedræbende forbindelse fra myrfarmeKredit:CC0 Public Domain Attmyrer er landmænd, og de dyrker svamp som føde. Pseudonocardia og Streptomyces bakterier er deres gårdmænd, producerer metabolitter, der beskytter afgrøden mod patogene
Ny svampedræbende forbindelse fra myrfarmeKredit:CC0 Public Domain Attmyrer er landmænd, og de dyrker svamp som føde. Pseudonocardia og Streptomyces bakterier er deres gårdmænd, producerer metabolitter, der beskytter afgrøden mod patogene -
 Direkte observation af desorption af en smelte af lange polymerkæderKredit:CC0 Public Domain I vores hverdag er det ikke ualmindeligt at se det samme materiale i forskellige tilstande. Tag for eksempel vand:det er en væske ved omgivelsestemperatur, vi kan omdanne
Direkte observation af desorption af en smelte af lange polymerkæderKredit:CC0 Public Domain I vores hverdag er det ikke ualmindeligt at se det samme materiale i forskellige tilstande. Tag for eksempel vand:det er en væske ved omgivelsestemperatur, vi kan omdanne
- Kan du få is til at gå i en kemisk ændring?
- Hvilken planet har mest af sateliten?
- Hvorfor følges alle breddegrad og længdegrad i Texas efterfulgt af bogstaverne N eller W?
- Matematik:Menneskelig opdagelse eller menneskelig opfindelse? | HowStuffWorks
- Går alle stjerner gennem scener?
- Vil du have, at sorte kvindelige studerende bliver i STEM? Hjælp dem med at finde rollemodeller, de…


