Hvad er pH for vandig ammoniak i forhold til pund pr. Gallon vand?
* ammoniakkoncentration: PH af ammoniakopløsning afhænger af koncentrationen af ammoniak (NH₃) i vandet. "Pund pr. Gallon" beskriver vægt, ikke koncentration.
* ligevægt: Ammoniak i vand findes i ligevægt med dens konjugatsyre, ammoniumion (NH₄⁺):
* NH₃ (aq) + H₂O (L) ⇌ NH₄⁺ (aq) + OH⁻ (aq)
* ph og ligevægt: Placeringen af denne ligevægt bestemmer koncentrationen af hydroxidioner (OH⁻), som igen bestemmer pH.
Her er hvad du har brug for at vide:
* Højere ammoniakkoncentration: En højere koncentration af ammoniak i vand vil skifte ligevægt til højre, hvilket øger hydroxidionkoncentrationen og resulterer i en højere pH (mere basisk).
* Nedre ammoniakkoncentration: En lavere koncentration af ammoniak vil skifte ligevægt til venstre, hvilket reducerer hydroxidionkoncentrationen og resulterer i en lavere pH (mindre basisk).
At beregne pH af ammoniakopløsning:
1. skal du kende koncentrationen af ammoniak (NH₃) i opløsningen. Dette udtrykkes normalt i molaritet (mol per liter) eller procent efter vægt.
2. Brug ligevægtskonstanten (KB) til ammoniak til at beregne hydroxidionkoncentrationen.
3.
Eksempel:
Lad os sige, at du har en løsning, der er 10% ammoniak efter vægt (ca. 1,4 m ammoniak). Ved hjælp af KB af ammoniak og ligevægtsreaktionen kan du beregne pH, som ville være omkring 11,6.
Kortfattet:
* Du kan ikke direkte konvertere PPG til pH.
* AMMONIA -OPTOLERNESPH -PH afhænger af * -koncentrationen * af ammoniak, ikke kun dens vægt.
* Du skal kende koncentrationen af ammoniak for at beregne pH.
 Varme artikler
Varme artikler
-
 Leder efter skjulte tilstande af COVID-19 spike-proteinetAtomisk model til binding af SARS-CoV-2 S-proteinet til ACE2-receptoren på værtscellemembranen. Kredit:University of California, Berkeleky; Istanbuls tekniske universitet Den virus, der skaber kao
Leder efter skjulte tilstande af COVID-19 spike-proteinetAtomisk model til binding af SARS-CoV-2 S-proteinet til ACE2-receptoren på værtscellemembranen. Kredit:University of California, Berkeleky; Istanbuls tekniske universitet Den virus, der skaber kao -
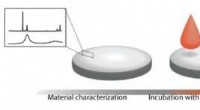 Palladiumbaseret metallisk glas med høj trombogen resistensSkematisk illustration afslører undersøgelser af materiale -blod -interaktioner via systematisk modifikation og analyse af materialemikrostruktur. Kredit:ETH Zürich Fremskridt inden for design af
Palladiumbaseret metallisk glas med høj trombogen resistensSkematisk illustration afslører undersøgelser af materiale -blod -interaktioner via systematisk modifikation og analyse af materialemikrostruktur. Kredit:ETH Zürich Fremskridt inden for design af -
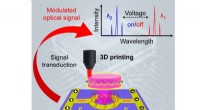 Ny rekord:3-D-printet optisk-elektronisk integrationSkematisk illustration af et integreret elektrisk styret mikrolasermodul til optoelektronisk hybridintegration. Kort, dette modul er designet til at være en termo-responsiv polymerresonator oven på et
Ny rekord:3-D-printet optisk-elektronisk integrationSkematisk illustration af et integreret elektrisk styret mikrolasermodul til optoelektronisk hybridintegration. Kort, dette modul er designet til at være en termo-responsiv polymerresonator oven på et -
 Magnesiumlegering som et lettere alternativ til aluminiumslegeringOrtogonal rillespændingspresning og hurtig udglødning krymper dramatisk kornstørrelsen af AZ31 magnesiumlegering, hvilket resulterer i øget styrke og duktilitet ved stuetemperatur. Før behandling (v
Magnesiumlegering som et lettere alternativ til aluminiumslegeringOrtogonal rillespændingspresning og hurtig udglødning krymper dramatisk kornstørrelsen af AZ31 magnesiumlegering, hvilket resulterer i øget styrke og duktilitet ved stuetemperatur. Før behandling (v
- Spændende tegn på faseskiftsturbulens i RHIC-kollisioner
- Når jorden er mellem måne og sol?
- SpaceX SN8 til at starte og flyve til 60, 000 fod i næste uge
- Hvilken type mikroorganisme lavede det kemikalie, der dræbte bakterier på pladen?
- Hvad er hastigheden på elektricitet eller lyn sammenlignet med lyd og lys?
- Grumsede søer overgår nu klare, blå søer i USA


