Hvilke elementer findes i fri elementær tilstand?
elementer, der ofte findes i deres frie elementære tilstand
* ædle gasser: Helium (He), Neon (NE), Argon (AR), Krypton (KR), Xenon (XE), Radon (RN) - Disse er meget ureaktive og findes som enkeltatomer.
* Nogle ikke -metaller:
* Hydrogen (H2) - findes som en diatomisk gas.
* Nitrogen (N2) - findes som en diatomisk gas.
* Oxygen (O2) - findes som en diatomisk gas.
* Svovl (S8) - fundet som et fast stof i form af den octatomiske allotrope (S8).
* Fosfor (P4) - findes som et fast stof i form af den tetratomiske allotrope (P4).
* Nogle metaller:
* Guld (AU) - Meget ureaktiv og findes ofte i sin oprindelige form.
* Sølv (AG) - relativt ureaktiv og findes ofte i sin oprindelige form.
* Platinum (PT) - meget ureaktiv og findes ofte i sin oprindelige form.
* Kobber (CU) - findes i sin oprindelige form, men det er mere almindeligt at finde det i malm.
Hvorfor findes disse elementer i deres frie tilstand:
* Lav reaktivitet: Ædle gasser og nogle ikke -metaller er meget ureaktive på grund af deres stabile elektronkonfigurationer. De danner ikke let obligationer med andre elementer.
* usædvanlige reaktioner: Nogle metaller som guld, sølv og platin er meget ureaktive og modstandsdygtige over for korrosion.
* Naturlig overflod: Elementer som brint, nitrogen og ilt er rigelige i atmosfæren.
Vigtige noter:
* allotropes: Elementer som svovl, fosfor og carbon kan eksistere i forskellige former kaldet allotropes (f.eks. Diamond, grafit og fulleren er allotropes af kulstof).
* sjældne tilfælde: Mens elementerne, der er anført ovenfor, ofte findes i deres frie tilstande, kan nogle også eksistere i forbindelser.
* Elemental State vs. Isoleret: Bare fordi et element findes i sin frie tilstand, betyder det ikke, at det er fuldstændigt isoleret. Det kan eksistere i en blanding med andre elementer.
Fortæl mig, hvis du har flere spørgsmål!
 Varme artikler
Varme artikler
-
 Ny 3D-printet sensor kan registrere glyphosat i drikkevarerIngeniører testede sensorenheden på prøver af appelsinjuice, som de tilsatte glyphosat til undersøgelsen. Kredit:Bob Hubner, Washington State University En nyudviklet, lavprissensor kan registrere
Ny 3D-printet sensor kan registrere glyphosat i drikkevarerIngeniører testede sensorenheden på prøver af appelsinjuice, som de tilsatte glyphosat til undersøgelsen. Kredit:Bob Hubner, Washington State University En nyudviklet, lavprissensor kan registrere -
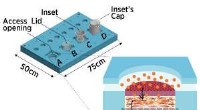 Rekonstruktion af hud på en chipMikrofluid hud-på-en-chip-enhed, der fungerer som et åbent system (A), en bioreaktor med låg (B), og et in vitro analysesystem udstyret med et åbent (C) eller et lukket skær (D). Nærbillede viser en g
Rekonstruktion af hud på en chipMikrofluid hud-på-en-chip-enhed, der fungerer som et åbent system (A), en bioreaktor med låg (B), og et in vitro analysesystem udstyret med et åbent (C) eller et lukket skær (D). Nærbillede viser en g -
 Ny platform til at skabe og karakterisere materialeblandinger kan fremskynde udviklingen markantYale University ph.d.-studerende Kristof Toth (billedet ovenfor) med det elektrosprayaflejringsværktøj, han designede, bygget, og valideret i samarbejde med stabsforsker Gregory Doerk fra Brookhaven L
Ny platform til at skabe og karakterisere materialeblandinger kan fremskynde udviklingen markantYale University ph.d.-studerende Kristof Toth (billedet ovenfor) med det elektrosprayaflejringsværktøj, han designede, bygget, og valideret i samarbejde med stabsforsker Gregory Doerk fra Brookhaven L -
 Nye bionedbrydelige polyurethanskum er udviklet af hvedestråKredit:CC0 Public Domain Hvert år produceres omkring 734 millioner tons hvedestrå på verdensplan, en stor mængde affald, som er billig og ikke har haft nogen veldefineret brug indtil nu. For nylig
Nye bionedbrydelige polyurethanskum er udviklet af hvedestråKredit:CC0 Public Domain Hvert år produceres omkring 734 millioner tons hvedestrå på verdensplan, en stor mængde affald, som er billig og ikke har haft nogen veldefineret brug indtil nu. For nylig
- Fordelene ved at være bitter:Hvordan tranebærets evolution gjorde det til en Thanksgiving-grundvar…
- Er Magmas klassificeret som påtrængende og ekstruderende?
- Hvilken energitilstand udfylder elektroner automatisk?
- Virkningerne af månefaserne på tidevand fra havet
- Hvad sker der med de arktiske og subarktiske søer i offseason?
- Samfund flygter fra udbruddet ved Guatemalas Ildvulkan


