Hvilken er mere opløselig i vandfenol eller natriumfenoxidion?
* Polaritet: Phenol er en svagt sur forbindelse på grund af hydroxylgruppen (-OH). Det danner hydrogenbindinger med vand, men interaktionen er ikke så stærk som med ioniske forbindelser. Natriumfenoxid er på den anden side en ionisk forbindelse dannet, når phenol reagerer med en stærk base som natriumhydroxid. Tilstedeværelsen af den negativt ladede phenoxidion (C6H5O-) gør det meget polært og derfor mere opløseligt i polært vand.
* Intermolekylære kræfter: Natriumfenoxidion interagerer med vandmolekyler gennem stærke ion-dipol-interaktioner, som er meget stærkere end hydrogenbindingen, der forekommer mellem phenol og vand.
* dissociation: Natriumfenoxidion dissocieres fuldstændigt i natriumioner (Na+) og phenoxidioner (C6H5O-) i vand, hvilket øger dets samlede opløselighed.
Kortfattet:
* Natriumfenoxid er ionisk og meget polær, hvilket fører til stærkere interaktioner med vandmolekyler.
* Phenol er svagt surt og mindre polært, hvilket resulterer i svagere interaktion med vand.
Derfor er natriumfenoxidion mere opløselig i vand end phenol.
 Varme artikler
Varme artikler
-
 Belysning af de elektroniske egenskaber ved enkeltvæggede kulstof nanohorn(a) TEM-billede af dahlia-formede SWCNH-bundter. Skalaen er 50 nm. (b) Raman-spektre af SWCNHer, exciteret med en 532 nm laser. Kredit:European Research Institute of Catalysis Enkeltvæggede kulstof
Belysning af de elektroniske egenskaber ved enkeltvæggede kulstof nanohorn(a) TEM-billede af dahlia-formede SWCNH-bundter. Skalaen er 50 nm. (b) Raman-spektre af SWCNHer, exciteret med en 532 nm laser. Kredit:European Research Institute of Catalysis Enkeltvæggede kulstof -
 Når livet giver dig citroner, lave bioplastLimonen kan være nøglen til nye, miljøvenlige polymerer. Kredit:Public domain Fra dit telefoncover til flyvinduer, polycarbonater er overalt. Flere millioner tons polycarbonat produceres hvert år
Når livet giver dig citroner, lave bioplastLimonen kan være nøglen til nye, miljøvenlige polymerer. Kredit:Public domain Fra dit telefoncover til flyvinduer, polycarbonater er overalt. Flere millioner tons polycarbonat produceres hvert år -
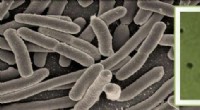 Brug af Raman mikrospektroskopi til hurtigt at opdage sygdomsfremkaldende bakterierKredit:Srividya Kumar Forskere ved Indian Institute of Science (IISc) har udviklet en metode til hurtigt at identificere og kontrollere, om en sygdomsfremkaldende bakterie er levende eller død. D
Brug af Raman mikrospektroskopi til hurtigt at opdage sygdomsfremkaldende bakterierKredit:Srividya Kumar Forskere ved Indian Institute of Science (IISc) har udviklet en metode til hurtigt at identificere og kontrollere, om en sygdomsfremkaldende bakterie er levende eller død. D -
 Vand skaber fælder i organisk elektronikTanvi Upreti, ph.d.-studerende ved afdelingen for komplekse materialer og anordninger, som udførte eksperimenterne sammen med den første forfatter, Guangzheng Zuo. Kredit:Charlotte Perhammar Organ
Vand skaber fælder i organisk elektronikTanvi Upreti, ph.d.-studerende ved afdelingen for komplekse materialer og anordninger, som udførte eksperimenterne sammen med den første forfatter, Guangzheng Zuo. Kredit:Charlotte Perhammar Organ
- Sollys passerer igennem, men opvarmer ikke Jorden Watercloudsor Air?
- Hvad er nettokraften på en 900 kg fly, der flyver med en konstant hastighed på 180 Moho North?
- Hvad kaldes en gruppe af lignende celler?
- Hvorfor arrangeres den periodiske tabel i kolonner og rækker?
- Billede:NASAs IceBridge undersøger gletschere i det nordøstlige Grønland
- Kan mennesker høre i rummet?


