Hvilken er mere reaktiv fluor eller nitrogen?
* Elektronegativitet: Fluor er det mest elektronegative element på den periodiske tabel. Dette betyder, at det har en stærk attraktion for elektroner.
* Elektronkonfiguration: Fluor har kun brug for endnu en elektron for at afslutte sin ydre skal, hvilket gør det meget reaktivt for at opnå stabilitet. Nitrogen har tre elektroner i sin ydre skal, hvilket gør det mindre ivrig efter at få elektroner.
* obligationsstyrke: Bindingerne dannet af fluor er generelt svagere end dem, der er dannet af nitrogen. Dette gør det lettere at bryde fluorbindinger og deltage i reaktioner.
Kortfattet: Fluorens høje elektronegativitet, ønske om at få en elektron og svagere bindinger gør det til et langt mere reaktivt element end nitrogen.
 Varme artikler
Varme artikler
-
 Undersøgelse af dynamikken i nanopartikeldannelse fra en forløber ved atomopløsningLavdosis atomopløsningsbilleddannelse af K2PtCl4. (A) Atommodellen af K2PtCl4-enhedscellen, med K i cyan, Pt i lilla, og Cl i pink. (B) Bright-field TEM billede af en stor K2PtCl4 krystallit. (C) Di
Undersøgelse af dynamikken i nanopartikeldannelse fra en forløber ved atomopløsningLavdosis atomopløsningsbilleddannelse af K2PtCl4. (A) Atommodellen af K2PtCl4-enhedscellen, med K i cyan, Pt i lilla, og Cl i pink. (B) Bright-field TEM billede af en stor K2PtCl4 krystallit. (C) Di -
 En ny metode til at kvantificere krystalhalvledereffektivitetUndersøgelse af krystallers unikke elektroniske egenskaber ved hjælp af ODPL-spektroskopi. Kredit:Kazunobu Kojima, Tohoku Universitet Japanske videnskabsmænd har fundet en ny måde at opdage effekt
En ny metode til at kvantificere krystalhalvledereffektivitetUndersøgelse af krystallers unikke elektroniske egenskaber ved hjælp af ODPL-spektroskopi. Kredit:Kazunobu Kojima, Tohoku Universitet Japanske videnskabsmænd har fundet en ny måde at opdage effekt -
 Hydrogel-baserede kapsler kan udvide sig og opholde sig i mave-tarmkanalen i dagevis, langsomt frigi…Jinyao Liu, venstre, og Giovanni Traverso strækker en ny hydrogel. For at sikre, at patienterne får deres fulde behandlingsforløb, forskere har udviklet et nyt sæt lægemiddelleveringsmaterialer lavet
Hydrogel-baserede kapsler kan udvide sig og opholde sig i mave-tarmkanalen i dagevis, langsomt frigi…Jinyao Liu, venstre, og Giovanni Traverso strækker en ny hydrogel. For at sikre, at patienterne får deres fulde behandlingsforløb, forskere har udviklet et nyt sæt lægemiddelleveringsmaterialer lavet -
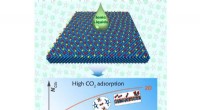 Todimensionelle ioniske væsker til effektivt at opfange kuldioxidDen ultrahøje CO2 adsorptionskapacitet af todimensionelle ioniske væsker. Kredit:IPE I forbindelse med globale bekymringer om klimaændringer og drivhusgaskontrol, en ny teknologi til CO2 fangst, ud
Todimensionelle ioniske væsker til effektivt at opfange kuldioxidDen ultrahøje CO2 adsorptionskapacitet af todimensionelle ioniske væsker. Kredit:IPE I forbindelse med globale bekymringer om klimaændringer og drivhusgaskontrol, en ny teknologi til CO2 fangst, ud
- Hvad er det sammensatte navn på HG2I2?
- Hvad hvis solen blev erstattet af et sort hul, hvordan ville det påvirke vores solsystem?
- NASA ser den tropiske cyklon Nora blive en orkan
- Hvordan påvirker nedbør mennesker?
- Kina sætter et mål for 2060 om at blive CO2-neutral
- Hvad er navnene på de første 3 planeter i solsystemet "?


