Hvad er forskellen mellem aluminiumssulfid og sulfat?
aluminiumssulfid (al₂s₃)
* sammensætning: To aluminium (AL) atomer og tre svovl (er) atomer.
* ionisk forbindelse: Aluminium er et metal, og svovl er en ikke -metal, så de danner en ionisk binding.
* egenskaber:
* Hvid krystallinsk fast stof
* Meget reaktiv med vand, der producerer hydrogensulfidgas (H₂S), som har en stærk rådnet æglugt.
* Brugt i nogle kemiske reaktioner og i produktionen af andre aluminiumsforbindelser.
aluminiumssulfat (al₂ (so₄) ₃)
* sammensætning: To aluminium (AL) atomer og tre sulfat (SO₄) -ioner.
* ionisk forbindelse: Aluminium er et metal, og sulfatgruppen (SO₄) er en polyatomisk ion, så de danner en ionisk binding.
* egenskaber:
* Hvid krystallinsk fast stof
* Opløselig i vand
* Brugt i forskellige applikationer:
* Vandbehandling (koagulation)
* Papirfremstilling
* Brandhæmmere
* Tekstilfarvning
Nøgleforskelle:
* anion: Aluminiumsulfid indeholder sulfidioner (S²⁻), mens aluminiumssulfat indeholder sulfationer (SO₄²⁻).
* reaktivitet med vand: Aluminiumssulfid reagerer voldsomt med vand, mens aluminiumssulfat opløses i vand.
* applikationer: Deres anvendelser er ganske forskellige, hvilket afspejler deres forskellige kemiske egenskaber.
Fortæl mig, hvis du har flere spørgsmål!
Sidste artikelHvor mange nitrogenatomer har aluminium?
Næste artikelHvad er bindingsvinklen for NO2?
 Varme artikler
Varme artikler
-
 Bryde molekylære trafikpropper med finnede nanoporøse materialer3D-finnede zeolitkatalysatorer forbedrer molekyladgang til det indre af partiklen. Kredit:J.C. Palmer Tusindvis af kemiske processer, der bruges af energiindustrien og til andre anvendelser, er af
Bryde molekylære trafikpropper med finnede nanoporøse materialer3D-finnede zeolitkatalysatorer forbedrer molekyladgang til det indre af partiklen. Kredit:J.C. Palmer Tusindvis af kemiske processer, der bruges af energiindustrien og til andre anvendelser, er af -
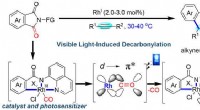 Synligt lys-induceret bifunktionel rhodiumkatalyse udviklet til decarbonylativ kobling af imider med…Lysinduceret bifunktionel rhodiumkatalyse til decarbonylering. Kredit:MIN Xiangting Carbonylgrupper er allestedsnærværende i lægemidler, naturlige produkter, og landbrugskemikalier, især amider. O
Synligt lys-induceret bifunktionel rhodiumkatalyse udviklet til decarbonylativ kobling af imider med…Lysinduceret bifunktionel rhodiumkatalyse til decarbonylering. Kredit:MIN Xiangting Carbonylgrupper er allestedsnærværende i lægemidler, naturlige produkter, og landbrugskemikalier, især amider. O -
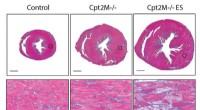 Undersøgelse viser, at fedt brændstof er nødvendigt for at vende hjertehypertrofiForskere ved Purdue University arbejder på at lære mere om forstørrelse af hjertet forårsaget af forhøjet blodtryk, diabetes, og fedme. Disse tværsnitsbilleder af et musehjerte viser den hurtige forst
Undersøgelse viser, at fedt brændstof er nødvendigt for at vende hjertehypertrofiForskere ved Purdue University arbejder på at lære mere om forstørrelse af hjertet forårsaget af forhøjet blodtryk, diabetes, og fedme. Disse tværsnitsbilleder af et musehjerte viser den hurtige forst -
 Maskinlæring muliggør et hidtil uset kig på polymerer, der er nyttige inden for biomedicinsk områ…Et team af forskere har udviklet en metode til at undersøge strukturerne af polymerer, der er følsomme over for ydre stimuli. Venstre til højre, Yaxin An, Karteek Bejagam, og Sanket Deshmukh. Kredit:V
Maskinlæring muliggør et hidtil uset kig på polymerer, der er nyttige inden for biomedicinsk områ…Et team af forskere har udviklet en metode til at undersøge strukturerne af polymerer, der er følsomme over for ydre stimuli. Venstre til højre, Yaxin An, Karteek Bejagam, og Sanket Deshmukh. Kredit:V
- Rejs 5 millioner år ind i Milky Ways -fremtiden
- Hvad er almindeligt anvendte gadgets baseret på princippet om Newton Law Motion?
- Hvordan er jorden på Hawaii?
- Er salt opløses i vand spontant eller ikke spontant?
- Langrækkende energitransport i perovskit nanokrystalfilm
- En klæbrig situation i udvikling


