Svovldifluoridionisk eller kovalent binding?
* Elektronegativitet: Fluor er meget elektronegativ (hvilket betyder, at det stærkt tiltrækker elektroner), og svovl er mindre elektronegativ. Forskellen i elektronegativitet mellem svovl og fluor er betydelig, men ikke stor nok til at danne ioniske bindinger.
* Deling af elektroner: Kovalente bindinger dannes, når atomer deler elektroner for at opnå en stabil elektronkonfiguration. I SF 2 , svovlatomet deler elektroner med hvert af de to fluoratomer, hvilket skaber et stabilt molekyle.
Nøglepunkter:
* ioniske bindinger: Form, når der er en stor forskel i elektronegativitet, hvilket resulterer i, at et atom helt tager et elektron fra et andet. Dette skaber ioner med modsatte afgifter, der tiltrækker hinanden.
* kovalente obligationer: Form, når atomer deler elektroner. Delingen kan være ens (ikke -polær kovalent) eller ulig (polær kovalent), afhængigt af forskellen i elektronegativitet.
Siden SF 2 Involverer deling af elektroner mellem svovl og fluor, det har kovalente bindinger.
Sidste artikelHvor mange atomer er der i et gram brint?
Næste artikelHvad er nogle egenskaber ved et atom?
 Varme artikler
Varme artikler
-
 En billigere måde at opskalere atomlagsaflejring påKunstnerisk illustration af atomlagsaflejring. Kredit:J. Luterbacher Kemiingeniører ved EPFL har udviklet en ny metode til atomlagsaflejring, en teknik, der almindeligvis anvendes i mikroelektroni
En billigere måde at opskalere atomlagsaflejring påKunstnerisk illustration af atomlagsaflejring. Kredit:J. Luterbacher Kemiingeniører ved EPFL har udviklet en ny metode til atomlagsaflejring, en teknik, der almindeligvis anvendes i mikroelektroni -
 Knækker den katalytiske kodeKredit:Argonne National Laboratory Den nyudviklede evne til at udnytte tidligere utilgængelige skifergasforekomster i løbet af det sidste årti har skabt en rigelig kilde af gasser, herunder metan,
Knækker den katalytiske kodeKredit:Argonne National Laboratory Den nyudviklede evne til at udnytte tidligere utilgængelige skifergasforekomster i løbet af det sidste årti har skabt en rigelig kilde af gasser, herunder metan, -
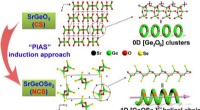 Ny delvis isovalent anionsubstitutionsinduktionsstrategi til design af infrarøde, ikke -lineære op…Strukturel transformation fra CS -forbindelse SrGeO3 til NCS SrGeOSe2. Kredit:Prof. ZHU’s Group Infrarøde ikke -lineære optiske (IR – NLO) materialer er afgørende for en bred vifte af applikatione
Ny delvis isovalent anionsubstitutionsinduktionsstrategi til design af infrarøde, ikke -lineære op…Strukturel transformation fra CS -forbindelse SrGeO3 til NCS SrGeOSe2. Kredit:Prof. ZHU’s Group Infrarøde ikke -lineære optiske (IR – NLO) materialer er afgørende for en bred vifte af applikatione -
 Forskere opdager trykinduceret polyamorfisme i tæt svovldioxidKredit:CC0 Public Domain Nogle stoffer vides at eksistere i flere forskellige strukturelt forstyrrede faste tilstande, et fænomen kendt som polyamorfisme. Det første og måske mest berømte eksempe
Forskere opdager trykinduceret polyamorfisme i tæt svovldioxidKredit:CC0 Public Domain Nogle stoffer vides at eksistere i flere forskellige strukturelt forstyrrede faste tilstande, et fænomen kendt som polyamorfisme. Det første og måske mest berømte eksempe


