Hvordan balanserer du redox H2O CL2 P4 - POCL3 HCI?
1. Identificer oxidation og reduktion halvreaktioner:
* Oxidation: P₄ → Pocl₃ (fosfor oxideres fra 0 til +5)
* reduktion: Cl₂ → HCL (klor reduceres fra 0 til -1)
2. Balance atomerne (undtagen H og O):
* Oxidation: P₄ → 4pocl₃
* reduktion: Cl₂ → 2HCI
3. Balance ilt ved at tilføje H₂O:
* Oxidation: P₄ + 12H₂O → 4pocl₃
* reduktion: Cl₂ → 2HCI
4. Balance brint ved at tilføje H⁺:
* Oxidation: P₄ + 12H₂O → 4pocl₃ + 24H⁺
* reduktion: Cl₂ + 2H⁺ → 2HCl
5. Balanceafgift ved at tilføje elektroner (E⁻):
* Oxidation: P₄ + 12H₂O → 4POCl₃ + 24H⁺ + 20E⁻
* reduktion: Cl₂ + 2H⁺ + 2E⁻ → 2HCl
6. Lav antallet af elektroner i begge halvreaktioner lige:
* Multiplicer reduktionen halvreaktion med 10:
10Cl₂ + 20H⁺ + 20E⁻ → 20HCl
7. Kombiner de afbalancerede halvreaktioner:
P₄ + 12H₂O + 10Cl₂ → 4pocl₃ + 20HCl
8. Endelig check:
* Sørg for, at antallet af atomer i hvert element er det samme på begge sider af ligningen.
* Sørg for, at den samlede opladning er den samme på begge sider (i dette tilfælde er det 0).
afbalanceret redoxreaktion:
P₄ + 12H₂O + 10Cl₂ → 4pocl₃ + 20HCl
 Varme artikler
Varme artikler
-
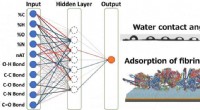 Et spring fremad for design af biomaterialer ved hjælp af AIKunstig neural netværksmodel, der bruges i dette arbejde Kredit: ACS Biomaterials Science &Engineering Forskere ved Tokyo Institute of Technology (Tokyo Tech) har brugt kunstig intelligens (AI) t
Et spring fremad for design af biomaterialer ved hjælp af AIKunstig neural netværksmodel, der bruges i dette arbejde Kredit: ACS Biomaterials Science &Engineering Forskere ved Tokyo Institute of Technology (Tokyo Tech) har brugt kunstig intelligens (AI) t -
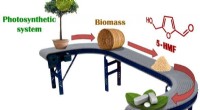 Grønnere medicinalindustrienDen nye proces er attraktiv, fordi den neutraliserer kulstof, som bidrager til globale klimaforandringer. Kredit:Zelinsky Institute of Organic Chemistry Syntetisering af livreddende lægemidler fra
Grønnere medicinalindustrienDen nye proces er attraktiv, fordi den neutraliserer kulstof, som bidrager til globale klimaforandringer. Kredit:Zelinsky Institute of Organic Chemistry Syntetisering af livreddende lægemidler fra -
 Forbedret proteinfunktion åbner vej for nyt koncept for lægemiddeludviklingKredit:CC0 Public Domain Forskere ved Karolinska Institutet og SciLifeLab i Sverige beskriver i en undersøgelse offentliggjort i Science hvordan de har forbedret et proteins evne til at reparere ox
Forbedret proteinfunktion åbner vej for nyt koncept for lægemiddeludviklingKredit:CC0 Public Domain Forskere ved Karolinska Institutet og SciLifeLab i Sverige beskriver i en undersøgelse offentliggjort i Science hvordan de har forbedret et proteins evne til at reparere ox -
 Selvsamling påkrævet:Neutrons sonde ny polymeradfærd for biomedicinske materialerORNL-instrumentforsker Shuo Qian forbereder Bio-SANS-instrumentet på HFIR til et eksperiment ledet af LSU-professor Donghui Zhang. Zhang bruger neutronspredning til at studere alsidige proteinlignende
Selvsamling påkrævet:Neutrons sonde ny polymeradfærd for biomedicinske materialerORNL-instrumentforsker Shuo Qian forbereder Bio-SANS-instrumentet på HFIR til et eksperiment ledet af LSU-professor Donghui Zhang. Zhang bruger neutronspredning til at studere alsidige proteinlignende
- NASAs nye Mars-rover kører på støvet rød vej, 1. tur 21 fod
- Identifikation af kick-hastighed, der er stor nok til individuelle gravitationsbølgehændelser efte…
- Hvilken slags vejr findes i stratusskyer?
- Dette lag af skorpen er tykkeste?
- To af verdens tearter uddøde i naturen ifølge ny rapport
- Forskere udvikler en ny klasse af anti-isoverflader


