Sammenlign kognings- og frysningspunkterne på 1M opløsningsglukose med en CaCl2. Hvorfor har CaCl2 højere lavere, forklar ikke bare, at det er daværende 3m?
kogepunkthøjde
* glukose: En 1M glukoseopløsning vil have et lidt højere kogepunkt end rent vand.
* cacl2: En 1M CACL2 -opløsning vil have et markant højere kogepunkt end rent vand.
Frysningspunktdepression
* glukose: En 1M glukoseopløsning vil have et lidt lavere frysepunkt end rent vand.
* cacl2: En 1M CACL2 -opløsning vil have et markant lavere frysepunkt end rent vand.
Hvorfor forskellen?
Forskellen i kogepunkthøjde og frysepunktdepression opstår fra begrebet kolligative egenskaber . Kolligative egenskaber afhænger udelukkende af antallet af opløste partikler i en opløsning, ikke typen af partikler.
Sådan fungerer det:
* dissociation: Glukose er en molekylær forbindelse og adskiller sig ikke i ioner, når det opløstes i vand. Det forbliver som individuelle glukosemolekyler.
* ionisering: CaCl2 er en ionisk forbindelse og adskiller sig i ioner, når de opløstes i vand. En formelenhed af CaCl2 producerer tre ioner:en ca²⁺ion og to cl⁻ioner.
Virkningen af ioner:
* Flere partikler: Ioniseringen af CaCl2 betyder, at en 1M -løsning faktisk indeholder tre gange Antallet af partikler som en 1M glukoseopløsning. Denne højere koncentration af partikler har en større effekt på de kolligative egenskaber.
* Forstyrrelse af opløsningsmiddelstruktur: Ioner fra CaCl2 forstyrrer hydrogenbindingsnetværket af vandmolekyler, hvilket gør det sværere for dem at danne en solid struktur (frysning) og gøre det lettere for dem at flygte ind i dampfasen (kogning).
Kortfattet
Mens både glukose- og CaCl2 -opløsninger udviser kogepunktforhøjning og frysepunktdepression, er størrelsen af disse effekter meget større for CaCl2, fordi det producerer flere partikler i opløsning på grund af ionisering. Dette er en direkte konsekvens af de kolligative egenskaber ved opløsninger.
Sidste artikelHvorfor er phenol mere sur end ethanol?
Næste artikelHvad er organiske peroxider?
 Varme artikler
Varme artikler
-
 Ingeniører evaluerer de faktorer, der påvirker batteriets ydeevne ved lave temperaturerKredit:CC0 Public Domain Energilagring med genopladelige batteriteknologier driver vores digitale livsstil og understøtter integration af vedvarende energi i elnettet. Batterifunktion under kolde f
Ingeniører evaluerer de faktorer, der påvirker batteriets ydeevne ved lave temperaturerKredit:CC0 Public Domain Energilagring med genopladelige batteriteknologier driver vores digitale livsstil og understøtter integration af vedvarende energi i elnettet. Batterifunktion under kolde f -
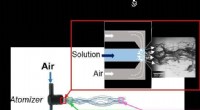 Forskere producerer filamenter og fibre tre gange finere end et menneskehårBeskrivelse af produktionen af PEG-fibre med de Flow Blurring-forstøvere, der blev brugt i undersøgelsen. Kredit:University of Sevilla En gruppe forskere fra Higher Technical School of Engineeri
Forskere producerer filamenter og fibre tre gange finere end et menneskehårBeskrivelse af produktionen af PEG-fibre med de Flow Blurring-forstøvere, der blev brugt i undersøgelsen. Kredit:University of Sevilla En gruppe forskere fra Higher Technical School of Engineeri -
 Forskere lykkes med materialesyntese for høj effektivitet i biologisk reaktionDGIST Professor Jaeheung Cho i Institut for Emerging Materials Science ved DGIST (op), Bohee Kim, en kombineret M.S-Ph.D. Programstuderende ved Institut for Emerging Materials Science (nedenfor til ve
Forskere lykkes med materialesyntese for høj effektivitet i biologisk reaktionDGIST Professor Jaeheung Cho i Institut for Emerging Materials Science ved DGIST (op), Bohee Kim, en kombineret M.S-Ph.D. Programstuderende ved Institut for Emerging Materials Science (nedenfor til ve -
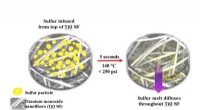 En stabiliserende påvirkning muliggør udvikling af lithium-svovlbatterierHot-press proceduren, udviklet hos Drexel, smelter svovl ind i nanofibermåtterne i et let tryksat, 140-graders celsius miljø - eliminerer behovet for tidskrævende behandling, der bruger en blanding af
En stabiliserende påvirkning muliggør udvikling af lithium-svovlbatterierHot-press proceduren, udviklet hos Drexel, smelter svovl ind i nanofibermåtterne i et let tryksat, 140-graders celsius miljø - eliminerer behovet for tidskrævende behandling, der bruger en blanding af
- Hvilken temp er 10c på Fahrenheit?
- Teknologifonden øger SoftBank Groups overskud med 36 procent
- Hvad var den fysiske beskrivelse for Ben i gåtur to måner?
- Sådan læses forstærkere på en analog multimeter
- Under hvilken proces tager planter og andre organismer i kuldioxid?
- Hvordan det pneumatiske dæk holder vores verden kørende


