Hvilke grupper af metaller er den mest aktive?
Her er hvorfor:
* Lav ioniseringsenergier: Disse metaller mister let deres yderste elektron (er) for at danne positive ioner. Denne lethed med at miste elektroner er det, der definerer deres reaktivitet.
* stærke reduktionsmidler: De er stærke reducerende midler, hvilket betyder, at de let donerer elektroner til andre stoffer.
* reaktivitet øges ned i gruppen: Når du bevæger dig ned ad gruppen, er de yderste elektroner længere væk fra kernen og lettere at fjerne, hvilket fører til stigende reaktivitet.
Eksempler:
* lithium (Li), natrium (NA), kalium (K), Rubidium (RB), Cesium (CS) (Gruppe 1)
* beryllium (BE), magnesium (Mg), calcium (CA), strontium (SR), barium (BA) (Gruppe 2)
Bemærk: Disse metaller er meget reaktive og skal håndteres med omhu. De reagerer voldsomt med vand og luft og opbevares ofte i olie eller inerte atmosfærer.
Sidste artikelHvilken er hurtigere reaktion af natrium med ilt eller francium -ilt?
Næste artikelHvad er pH -antallet af siliciumhydroxid?
 Varme artikler
Varme artikler
-
 Nyudviklet COVID-19-test registrerer og identificerer specifikke varianter med 100 % nøjagtighedKredit:Unsplash/CC0 Public Domain University of California, Irvine forskere har udviklet en COVID-19-test, der detekterer og identificerer specifikke SARS-CoV-2-varianter med 100 % nøjagtighed. I e
Nyudviklet COVID-19-test registrerer og identificerer specifikke varianter med 100 % nøjagtighedKredit:Unsplash/CC0 Public Domain University of California, Irvine forskere har udviklet en COVID-19-test, der detekterer og identificerer specifikke SARS-CoV-2-varianter med 100 % nøjagtighed. I e -
 Slamdrevne bakterier genererer mere elektricitet, hurtigereKAUST-forskere har identificeret en ny elektroaktiv bakterie, kaldet Desulfuromonas acetexigens, der producerer en højere strømtæthed end en traditionelt brugt bakterie, og på kortere tid. Kredit:KAUS
Slamdrevne bakterier genererer mere elektricitet, hurtigereKAUST-forskere har identificeret en ny elektroaktiv bakterie, kaldet Desulfuromonas acetexigens, der producerer en højere strømtæthed end en traditionelt brugt bakterie, og på kortere tid. Kredit:KAUS -
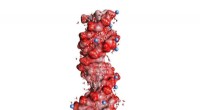 Nye dynamiske sonder til ioner, der interagerer med biomolekylerFig. 1:DNA dobbelt helix indlejret i vand (vinklede små molekyler, ikke i skala). De mørkerøde kugler på helixoverfladen repræsenterer oxygenatomer i de negativt ladede PO2-enheder, de blå kugler posi
Nye dynamiske sonder til ioner, der interagerer med biomolekylerFig. 1:DNA dobbelt helix indlejret i vand (vinklede små molekyler, ikke i skala). De mørkerøde kugler på helixoverfladen repræsenterer oxygenatomer i de negativt ladede PO2-enheder, de blå kugler posi -
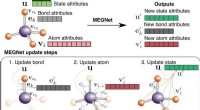 Ingeniører bruger grafnetværk til nøjagtigt at forudsige egenskaber af molekyler og krystallerSkematisk illustration af MEGNet-modeller. Kredit:Chi Chen/Materials Virtual Lab Nanoingeniører ved University of California San Diego har udviklet nye deep learning-modeller, der præcist kan foru
Ingeniører bruger grafnetværk til nøjagtigt at forudsige egenskaber af molekyler og krystallerSkematisk illustration af MEGNet-modeller. Kredit:Chi Chen/Materials Virtual Lab Nanoingeniører ved University of California San Diego har udviklet nye deep learning-modeller, der præcist kan foru


